Nature | 清华大学等团队揭示配体效应如何调控μ阿片受体的构象动态
来源:生物探索 2024-04-12 13:56
该研究检测了9种具有独特药理特征的具有代表性的µOR配体对TM6构象和动力学的影响,包括纳洛酮(拮抗剂)、TRV130、PZM21等。
清华大学陈春来、斯坦福大学Brian Kobilka及加州大学洛杉矶分校Matthias Elgeti共同通讯在Nature 在线发表题为“Ligand efficacy modulates conformational dynamics of the µ-opioid receptor”的研究论文,该研究展示了使用双电子-电子共振和单分子荧光共振能量转移,如何在换能器水平上将μOR的配体特异性构象变化转化为广泛的内在效率。
该研究确定了在不同时间尺度上相互转换的受体细胞质表面的几种构象,包括能够与G蛋白结合的预激活构象,以及显著降低三元复合物内GDP亲和力的完全激活构象。β-arrestin-1与µOR核心结合位点的相互作用的特异性较低,其亲和力远低于Gi的结合。

µOR是家族A G蛋白偶联受体(GPCR),是重要的镇痛药物靶点。然而,吗啡和芬太尼等阿片类药物激活μOR也可能导致不同程度的不良反应,包括便秘、耐受性和呼吸抑制。µOR激活Gi/o家族G蛋白并募集β-阻滞蛋白-1和2。以前认为µOR信号传导的镇痛作用是由G蛋白信号传导介导的,而呼吸抑制是由β-抑制蛋白募集介导的。因此,优先激活G蛋白的配体,也称为G蛋白偏向激动剂,预计会表现出较弱的副作用。为此,研究人员开发了一系列偏向G蛋白的配体,包括TRV130、PZM21、洛芬太尼比帽柱木碱(MP)和SR-17018。然而,尽管配体偏向于G蛋白信号传导导致β-抑制蛋白介导的耐受性降低,但最近的研究表明,过强的G蛋白信号传导(超功效)是导致呼吸抑制的原因,而功效较低的部分激动剂提供了更安全的治疗效果。
高分辨率结构提供了对µOR激活和µOR介导的G蛋白信号传导的结构基础的一些见解。Gi的C端螺旋与7-跨膜螺旋束细胞质表面的一个开口结合,该开口是由跨膜螺旋613-16 (TM6)的胞内端向外移动约10-Å形成的。目前,与β-阻滞蛋白的复合物中仍没有高分辨率的µOR结构,这可能是由于缺乏稳定或结构同质的蛋白复合物。然而,由X射线晶体学和冷冻电镜(cryo-EM)确定的结构通常代表了一个大集合中最稳定和均匀的构象的快照。大多数GPCR- G蛋白复合物结构在无核苷酸状态下被确定,这是一种高度稳定的状态,在细胞中存在GDP和GTP的生理浓度时可能不代表活性状态。不稳定激发态的构象及其在构象集合内的相对种群可能不适于结构确定,但它们是下游信号的重要调制器。
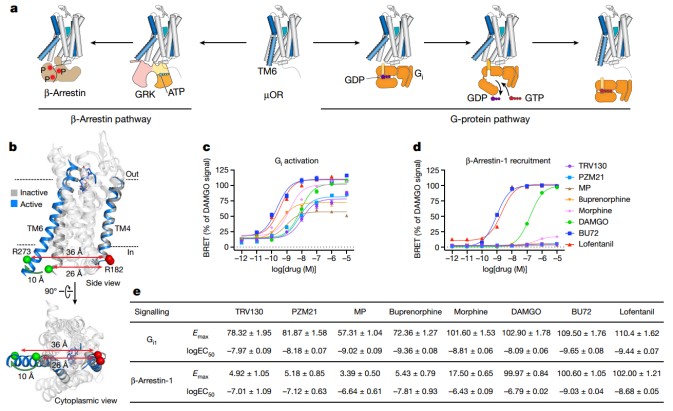
µOR的配体依赖性活化(Credit: Nature)
该研究检测了9种具有独特药理特征的具有代表性的µOR配体对TM6构象和动力学的影响,包括纳洛酮(拮抗剂)、TRV130、PZM21、MP(低效G蛋白偏激剂)、丁丙诺啡(低效激动剂)、吗啡(高效激动剂)、DAMGO(高效参比激动剂)、BU72和洛芬太尼(超高效激动剂)。
研究人员研究了配体和换能器结合对构象平衡和换能器激活的协同作用,特别是G蛋白的核苷酸释放。研究结果表明,在快速和慢速时间尺度上交换构象状态的µOR的构象集合是如何通过配体结合进行微调的,从而产生独特的效果和信号偏差。总的来说,这项研究不仅提高了人们对µOR激活机制的理解,也为开发新型的、副作用更小的镇痛药物提供了理论基础。随着对GPCR动态结构和功能之间关系的进一步探索,未来有望开发出更为安全有效的治疗方案,以更好地应对疼痛和其他相关疾病。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


