新冠检测,3分钟出结果!跟测酒驾一样简单!
来源:生物探索 2022-05-02 12:25
美国食品和药品管理局(Food and Drug Administration,FDA)为首个新冠诊断测试设备(InspectIR, PNY-1000)颁发紧急使用授权(Emergency Use A
美国食品和药品管理局(Food and Drug Administration,FDA)为首个新冠诊断测试设备(InspectIR, PNY-1000)颁发紧急使用授权(Emergency Use Authorization,EUA)(图1)。该设备收集呼吸样本,无需鼻咽拭子,整个过程耗时不到3分钟。设备尺寸接近普通行李箱,方便携带,可在医院、公共场所和移动测试站点使用。

图1 FDA授权首个新冠呼气检测设备EUA(图源:FDA官网)
InspectIR联合创始人John Redmond表示:“工作场所大规模集中式新冠检测需求日渐提升,而第三方新冠核酸检测太费时费事,不适合工作场所。PNY-1000简单易操作,非常适合工作场所使用。只要办公室放一两台PNY-1000,员工上班前就像“打卡”一样过去测一下,3分钟就有结果,几乎不浪費时间。不必像核酸检测那样需要等一段时间才有结果,不仅耽误时间,而且可能会导致病毒扩散。”
该设备的生产商为InspectIR Systems LLC(简称“InspectIR”),商品名为InspectIR COVID-19 Breathalyzer,型号为PNY-1000。InspectIR成立于2018年,注册地为美国达拉斯,并于2019年11月26日完成种子轮融资。InspectIR与北德克萨斯大学合作,基于特有专利技术,致力于研发便携式非侵入性阿片类药物/大麻/麻醉品的呼气检测工具,创造了第一台真正定性和定量麻醉品便携测试仪。
InspectIR首席执行官Tim Wing表示:“几十年来,药物检测市场一直完全基于尿液和血液分析,InspectIR的产品将提供更详细的定性和定量结果,其结果准确性不仅可与尿检、血液检测结果相媲美,而且检测速度更快,可在几秒钟内实现结果呈现。我们的产品将带来传统检测缺失的检测速度,方便快速执法,从而颠覆麻醉品检测行业。”
InspectIR不仅局限于麻醉药品检测,同样的技术路线也适用于新冠病毒检测。InspectIR在2020年就已开发出了PNY-1000,后续的测试和合规流程用了将近两年的时间。随着FDA正式给予其EUA授权,这款检测仪可应用到大规模集中新冠检测场景(图2)。

根据FDA公布的InspectIR授权书显示,PNY-1000本质上是一款VOC频谱检测仪,是一种定性分析设备,用于检测与SARS-CoV-2感染相关的5种呼吸挥发性有机化合物(Volatile Organic Compounds,VOC)代谢物[1]。PNY-1000采用医疗、司法界等视为金标准的气相色谱-质谱法联用技术,能够从被测对象的呼吸中快速、准确地检测上述五种有机物的含量,作为是否感染新冠的判定标准(图3)。

2022年3月,The Lancet子刊eClinical Medicine曾发表题为“Detection of SARS-CoV-2 infection by exhaled breath spectral analysis: Introducing a ready-to-use point-of-care mass screening method”的研究成果(图4)[2]。在此项研究中发现新冠感染者的呼吸中包含醛类、酮类和醇类气体,并且这些气体不会在其它主流病症(甚至包括典型肺炎)患者的呼吸中出现,具有新冠特异性。这也为PNY-1000的研发提供了科学依据,PNY-1000能够检测乙醛、辛醛、丙酮、丁酮和甲醇5种已知和新冠病毒感染有着强关联的有机物。

图4 研究成果(图源:eClinical Medicine)
根据FDA发布的PNY-1000测试文件显示,PNY-1000的测试过程为:在测试前15分钟内受试者不应进食、饮水或使用任何烟草制品。首先,真空泵抽空系统对采集到的受试者在10秒内提供的0.25L呼吸样本进行真空处理。随后,呼吸样本与系统中的预浓缩器相互作用以收集和浓缩样本,并由下游残余气体分析仪检测特定VOC。最后,通过运行算法确定样本中存在的VOC及比例,输出SARS-CoV-2检测结果:阳性为(+),阴性为(-)。测试结果将在不到3分钟的时间内显示在仪器屏幕上。所有阳性检测结果都必须通过高度敏感的SARS-CoV-2检测进行后续确认[3]。
对2409名受试者样本进行检测,发现阳性检测的准确率达到91.2%,阴性检测的准确率则高达99.3%。检测样本包括德尔塔、奥密克戎等变种。这组数据证明,对于没有感染新冠病毒的受试者,PNY-1000检测的准确性非常高,“假阳性”的可能性很低;而对于阳性感染者来说,这一检测方式的准确性,也达到了包括美国在内的很多国家公共卫生机构对于快速检测法的一般要求。
常规抗体检测法一直无法有效避免抗原交叉反应对检测结果造成的影响,受试者感染其它流行病(例如冠状病毒导致的流感)可能导致在新冠检测中出现假阳性;而正因为前述的挥发性有机物只与新冠病毒感染有着关联,所以可以避免抗原交叉反应。作为一款快速检测方式,PNY-1000对于阴性受试者的检测准确度高达99.3%,出现假阳性的概率非常低。虽然PNY-1000表现良好,但FDA也明确表示,这种吹入式检测方式仍然不能替代核酸检测的地位,阳性结果应该追加进行核酸检测来最终确认。
4月22日,John Redmond表示“目前每台机器每小时只能处理大约20个样本,因此进行大规模筛查时需要很多设备。首批设备可能需要10到12周才能上市,每次测试的成本约为10至12美元。”FDA称,该公司表示计划每周生产约100台设备,但目前尚不清楚何时会达到这一水平。一些新冠呼气测试已经在试点项目中进行了测试或授权在其他国家使用,但InspectIR Breathalyzer将是第一个在美国上市的产品。
麻省理工大学医学院分子生物学家Nathaniel Hafer说:“PNY-1000检测新冠又快又准,让人印象深刻,基于此项技术,扩大可检测病毒类型是非常有价值的。”
加州大学戴维斯分校副校长Cristina Davis一直在研发冠状病毒检测技术,她表示:“我认为这对整个呼吸分析领域来说是一个非常令人振奋的发展,这是向前迈出的一大步。”
埃默里大学和乔治亚研究所的儿科血液学家和生物工程师Wilbur Lam博士说:“我们一直在考虑针对整个大流行进行此类型的测试,也一直在等待获得授权的产品和技术,但只有在实际应用中才能真正确定PNY-1000有多大用处。PNY-1000并没有给你一个确切的诊断,它给你的是一种与疾病相关的生化模式。”
南加州大学凯克医学院临床微生物学家Susan Butler-Wu表示:“还是希望能够看到更多关于PNY-1000设备性能的独立数据,以及它所检测到的化合物更多细节。挥发性有机化合物在感染诊断方面没有得到很好的发展,如果没有获得更多现实数据,我觉得用它来诊断病人为时尚早。”
传染病检测主要有两种方式:检测病原体本身或者检测人体为了抵抗病原体而产生的抗体。检测病原体即可以检测抗原(一般是病原体表面蛋白,有些用内部核蛋白),也可以检测核酸。针对新冠病毒的检测,主要分为核酸检测、抗原检测、抗体检测三种(表1)。其中抗原检测试剂操作简单、检测速度快,适用于大规模筛查场景,目前在疫情较严重的海外国家得到广泛应用,而核酸检测目前是尽早确定是否感染新冠病毒最有效的检测方法。
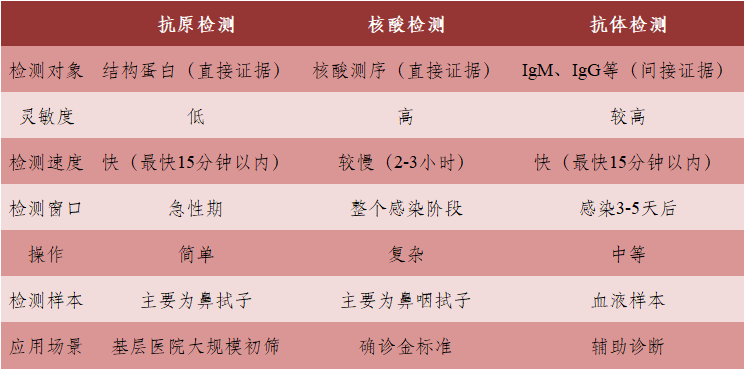
新冠抗原检测,在进行大规模、快速筛查检测时,具有较高的社会价值,居民可以自行购买检测试剂,居家自检,免除长时间等待核酸检测结果的不便,降低检测过程中的曝露风险,也解决了偏远、基层地区无法进行核酸检测的困难。
2021年3月11日,国家卫健委发布消息,国务院应对新型冠状病毒肺炎疫情联防联控机制综合组决定在核酸检测基础上,增加抗原检测作为补充,并组织制定了《新冠病毒抗原检测应用方案(试行)》(图5)。进一步明确了抗原检测的补充定位,提升的是“早发现”能力,并且使用的重点是在不具备核酸检测能力的卫生机构。
图5 新冠病毒抗原检测应用方案(试行)通知(图源:医政医管局官网)
据统计,基层医疗卫生机构诊疗检测需求市场规模约55亿元,隔离观察人员检测需求约25亿元,社区居民自检需求约249亿元,整体合计超300亿元。长期视角下,假设新冠常态化下的社会开放后,按照新冠抗原检测的应用场景分为静态的自测以及动态的大规模检测,综合来看,长期视角下抗原检测市场规模可达2700亿元[4]。
截止4月20日,国家药监局已批准29个新冠病毒抗原检测试剂。中国新冠抗原检测自检类试剂盒批准时间较欧洲、美国等地区晚,我国部分公司的抗原检测产品也已在欧洲或美国得到批准并市场销售(表2)。2021年全年,中国新冠检测试剂盒(核酸检测+抗体检测+抗原检测)合计出口金额约714亿元,进口国家主要是德国和英国。
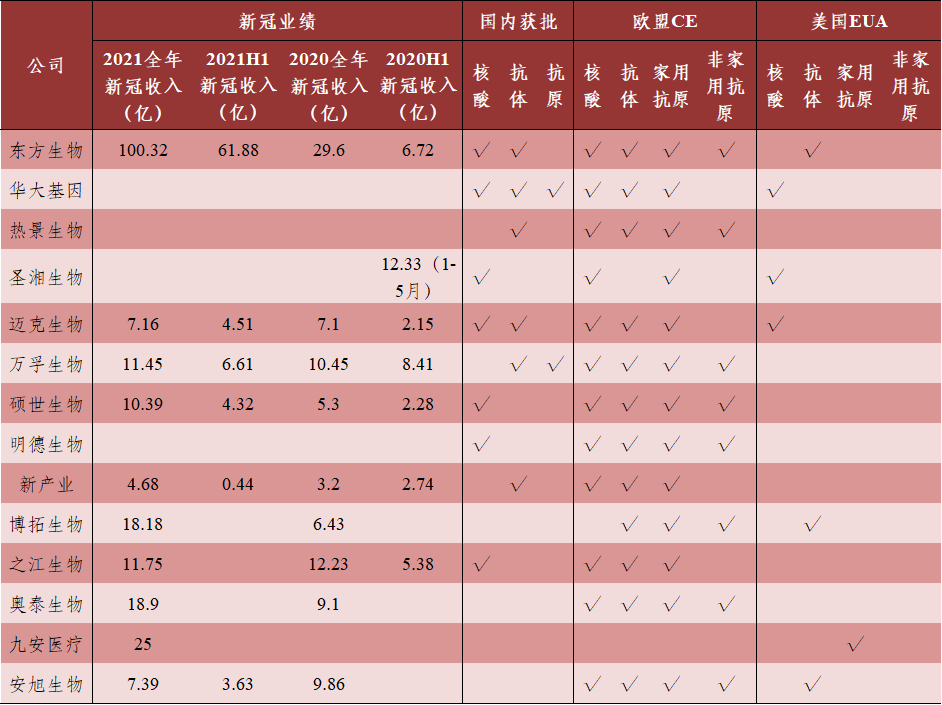
数据来源:各公司公告、NMPA丨制表:生物探索编辑团队
欧洲市场,用于家用检测抗原检测试剂产品较多,价格战激烈,终端价格约在2-3欧元左右。以德国为例,我国的艾康生物、安旭生物、万泰生物、热景生物、明德生物、博拓生物等公司产品均被德国药监局批准用于家用,其他公司如万孚生物、亚辉龙、东方生物、乐普生物等产品也获得CE认证。
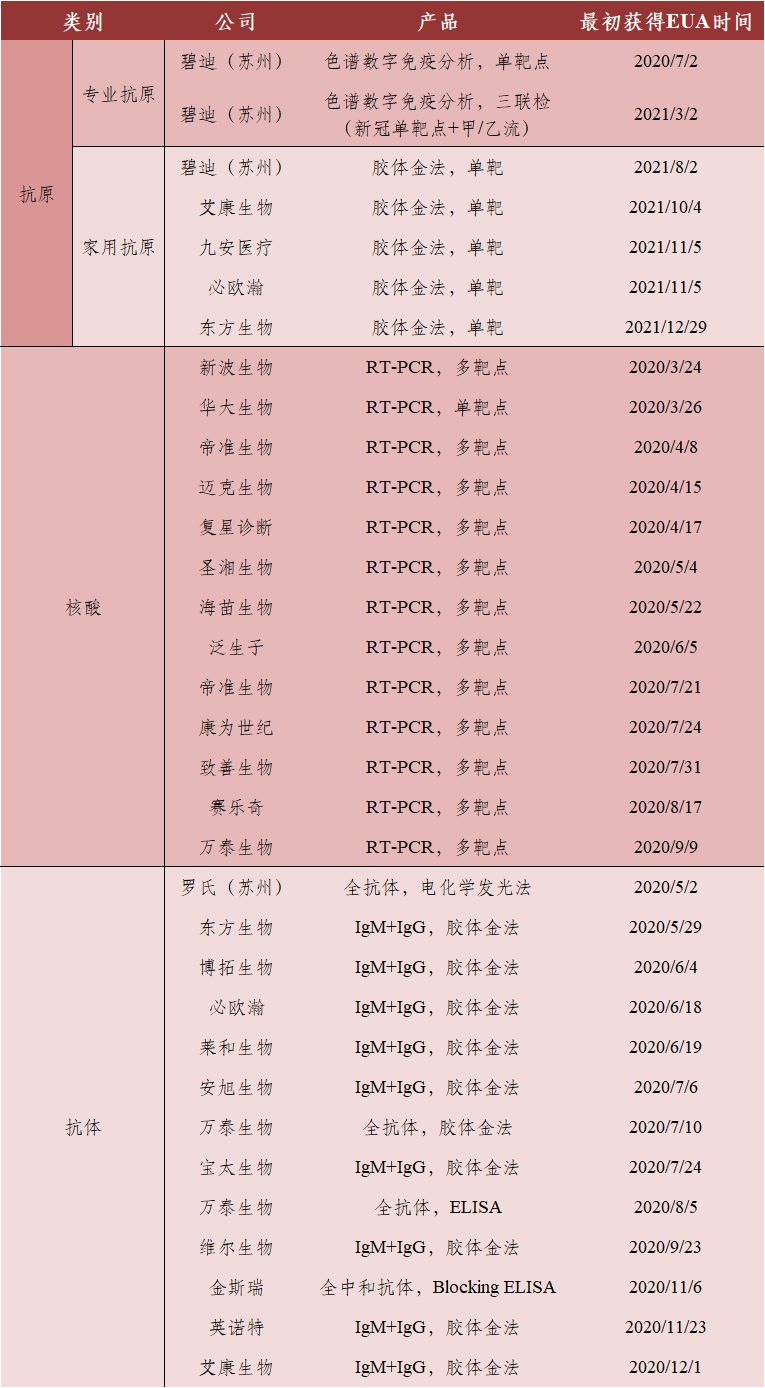
美国市场FDA对家用新冠抗原检测试剂盒的审批较为严格,市场竞争格局较优,我国仅有5家公司拿到美国的EUA,分别是艾康生物、九安医疗、碧迪、必欧瀚和东方生物(为西门子的代工商)(表3)。
PNY-1000不同于以往的技术路线,势必为新冠检测市场带来新的改变。如果真的能够做到高灵敏度、高准确性和高性价比,那么PNY-1000也不失为新冠检测的好选择。
版权声明
本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->













