《癌症通讯》:又现一员促癌大将!复旦中山医院团队揭示调控乳酸代谢,帮癌细胞教唆巨噬细胞促癌的重要靶点
来源:奇点糕 2024-09-19 14:02
对巨噬细胞组分的分析显示,敲除或沉默Srsf10显著减少了促癌的M2-TAMs占比,使有利抗癌的M1型TAMs占比上升,且SRSF10表达水平与M2-TAMs典型标志物正相关。
近日,复旦大学附属中山医院肝癌研究所代智研究员团队在《癌症通讯》(Cancer Communications)期刊发表的最新研究成果,就揭示了丝氨酸/精氨酸剪接因子10(SRSF10)在肝细胞癌(HCC)中的又一重促癌机制:SRSF10能够通过调节糖酵解和乳酸代谢,帮助癌细胞将巨噬细胞导向促癌的M2表型(M2-TAMs),介导免疫逃逸和免疫治疗耐药[1]!
具体来说,SRSF10会与经典癌基因MYB RNA的3′非翻译区结合增强其稳定性,从而经由MYB上调葡萄糖转运蛋白1(GLUT1)、乳酸脱氢酶A(LDHA)等糖酵解过程关键酶的表达,在细胞内外积聚更多乳酸,而乳酸增多诱导的组蛋白乳酸化修饰又会上调SRSF10表达,并导致巨噬细胞组蛋白广泛发生H3K18乳酸化(H3K18la),使它们转变为抑制免疫细胞的促癌表型,因此SRSF10有着成为增敏HCC免疫治疗靶点和临床实用Biomarker的潜力。

论文首页截图
其实在一年多以前,SRSF10就在奇点糕这儿露过脸,而且很巧的是同样是我国学者的研究,同样在HCC中开展,但当时SRSF10还只能算是做了点本职工作以外的拓展,影响的对象是细胞周期调节因子CDC25A,这回跨界到影响糖酵解和乳酸代谢,还是挺让人意外的。
中山医院团队此次的研究,出发点则是寻找影响HCC免疫治疗效果的关键基因,在对6例HCC患者(4例对免疫治疗无应答)进行单细胞测序,并比对既往测序数据后,研究者们发现无应答患者的恶变肝细胞,普遍存在糖酵解通路关键基因的表达显著富集(对比应答患者),Srsf10就是这些基因中的一员,且它是唯一仅在癌细胞中表达上调的基因。
外部数据库资料还显示,SRSF10的表达上调往往与免疫抑制性肿瘤微环境同时出现,研究者们也通过敲除HCC模型小鼠的Srsf10证实了这一点,敲除Srsf10使HCC微环境内的CD4+/CD8+T细胞数量显著增多,而典型巨噬细胞亚群减少,说明巨噬细胞大概率是受SRSF10影响,在肿瘤微环境中导致免疫抑制的具体执行人。
对巨噬细胞组分的分析显示,敲除或沉默Srsf10显著减少了促癌的M2-TAMs占比,使有利抗癌的M1型TAMs占比上升,且SRSF10表达水平与M2-TAMs典型标志物正相关;研究者们还专门进行了共培养实验,证实未敲除Srsf10的HCC细胞确实有使巨噬细胞向M2型极化促癌的能力,且巨噬细胞也是抑制CD8+T细胞免疫功能时必不可缺的。
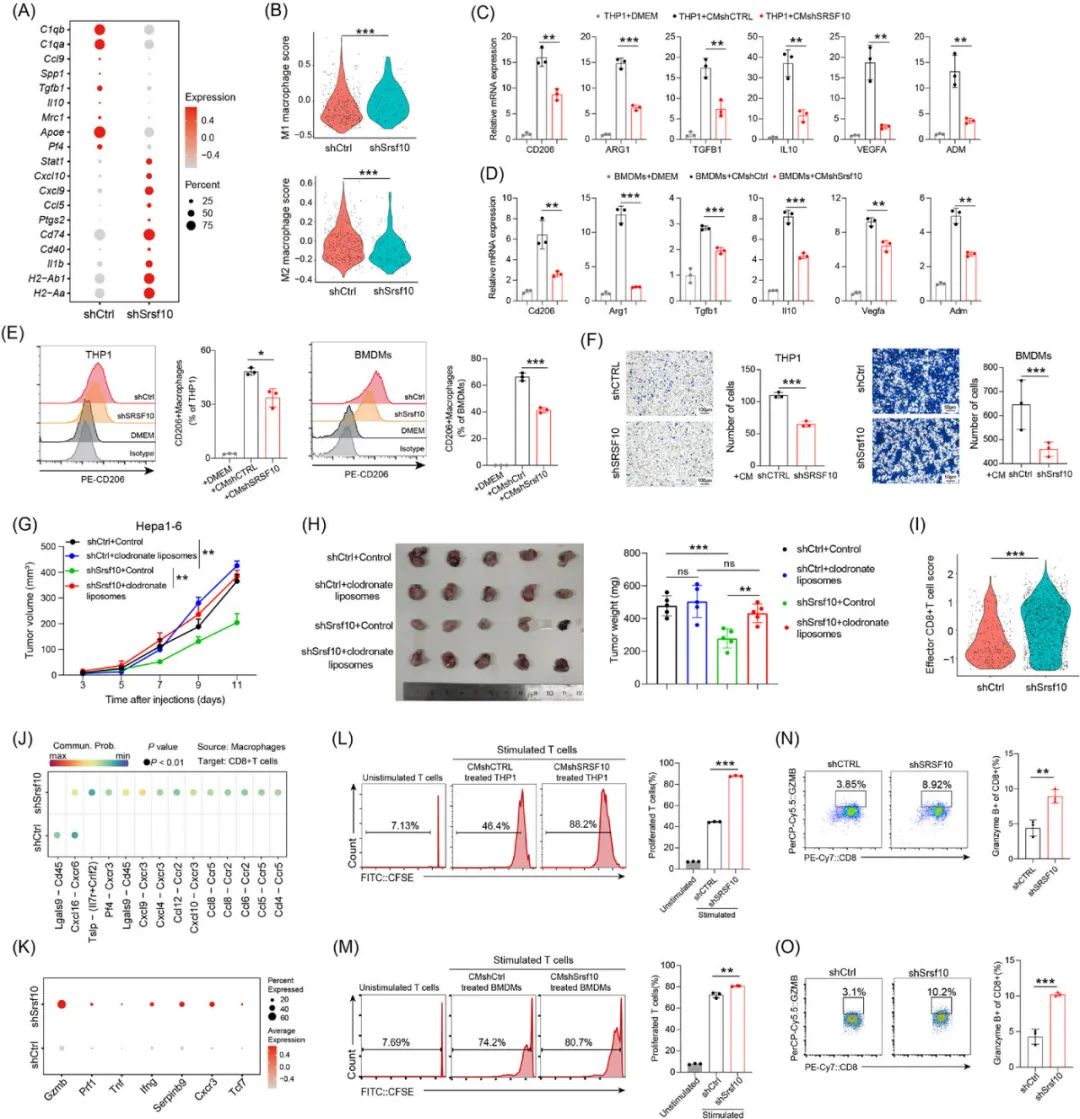
SRSF10可通过使巨噬细胞向M2型极化,介导免疫抑制性肿瘤微环境
既然前面的单细胞测序已经显示,SRSF10与糖酵解通路相关,乳酸又是糖酵解的产物,下一步的机制探索自然就要看乳酸:共培养实验首先显示,乳酸可逆转敲除HCC细胞Srsf10导致的M2-TAMs减少等影响,而环境中缺少葡萄糖时,是否敲除或沉默Srsf10也不会产生明显影响,说明糖酵解产生乳酸是必要条件;乳酸调控巨噬细胞的具体机制则是组蛋白H3K18la修饰,这会使多个M2-TAMs的关键基因,如CD206、ARG1和IL10转录激活。
同时,研究者们还明确了SRSF10在HCC细胞中能够对糖酵解正向调控,并证实与此前在乳腺癌中的发现[2]类似,SRSF10使糖酵解增强产生的更多乳酸,还会通过乳酸化修饰转录激活SRSF10,正反馈通路就此形成,促癌效应也就停不下来了。
而导致上面一切改变的源头事件,就是SRSF10与MYB这个强力转录因子RNA的3′非翻译区结合,增强了RNA的稳定性,随后MYB就会激活GLUT1等参与糖酵解的关键酶,使乳酸增多导致免疫抑制;沉默Srsf10或使用专门抑制剂阻断这个“罪恶链条”,就能与PD-1抑制剂协同增效,患者来源类器官实验也初步证实了可行性。此外,HCC患者的SRSF10表达水平也与免疫治疗耐药和不良预后相关,提示SRSF10或可作为Biomarker。
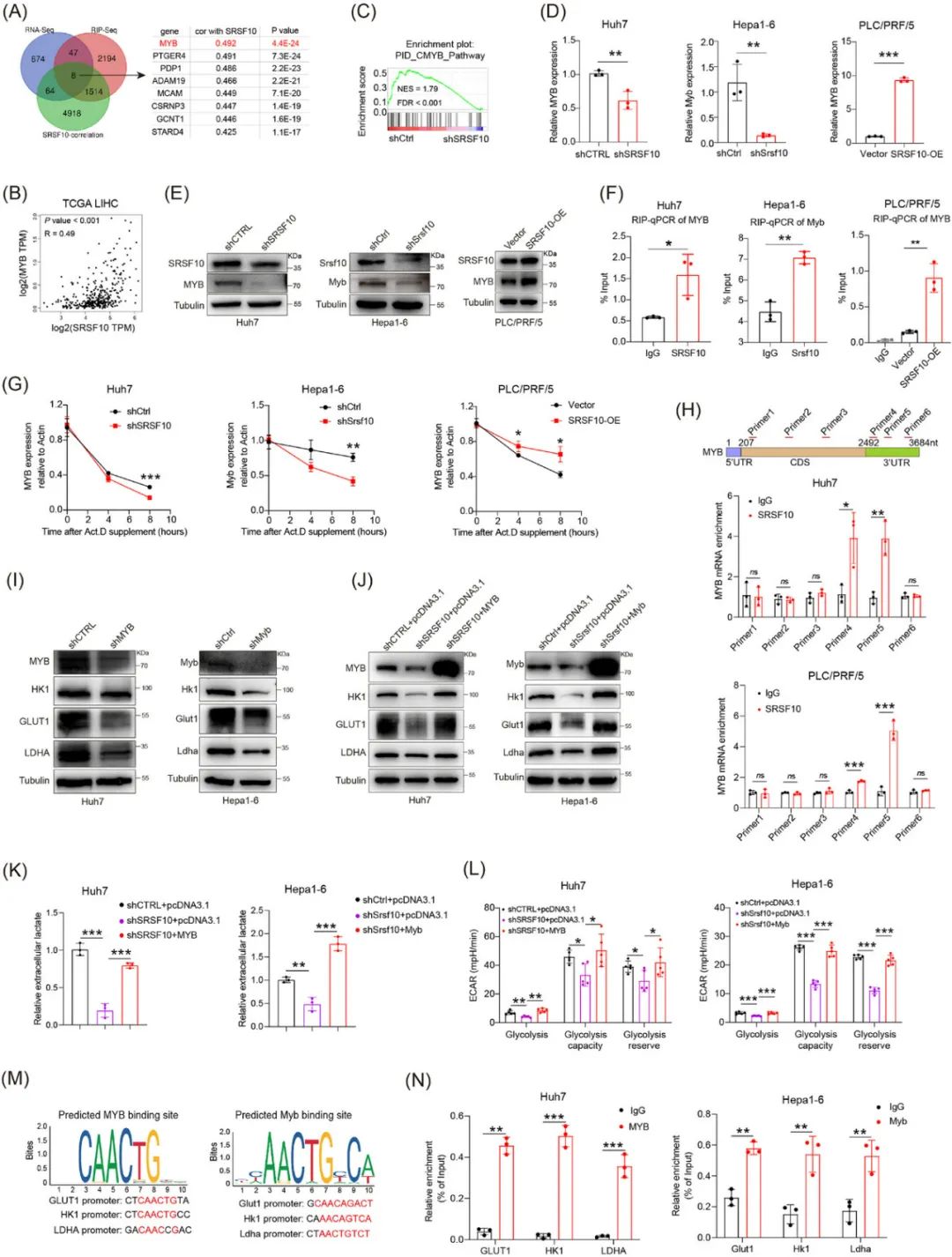
SRSF10与MYB RNA结合,从而上调糖酵解来实现后续免疫抑制
参考文献:
[1]Cai J, Song L, Zhang F, et al. Targeting SRSF10 might inhibit M2 macrophage polarization and potentiate anti-PD-1 therapy in hepatocellular carcinoma[J]. Cancer Communications, 2024.
[2]Pandkar M R, Sinha S, Samaiya A, et al. Oncometabolite lactate enhances breast cancer progression by orchestrating histone lactylation-dependent c-Myc expression[J]. Translational oncology, 2023, 37: 101758.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


