Cell子刊:王从义/孙飞团队发现新型脂肪巨噬细胞,可加剧肥胖和代谢紊乱的发展
来源:生物世界 2024-09-21 10:07
该研究利用纳米材料结合siRNA靶向巨噬细胞,发现PDIA3作为肥胖免疫干预靶点,具有广泛的临床转化潜力。
华中科技大学同济医学院附属同济医院王从义教授团队在 Cell Metabolism 期刊发表了题为:PDIA3 defines a novel subset of adipose macrophages to exacerbate the development of obesity and metabolic disorders 的研究论文。该研究表明,PDIA3定义了一种新型脂肪组织巨噬细胞亚群,可加剧肥胖和代谢紊乱的发展。

该研究通过对正常和肥胖患者脂肪组织样本进行单细胞测序,观察到在肥胖个体中累积了一群独特的脂肪组织巨噬细胞(adipose tissue macrophage,ATM)亚群,定义为ATF4hi PDIA3hi ACSL4hi CCL2hi炎症和代谢激活的巨噬细胞(inflammatory and metabolically-activated macrophage,iMAM)。
ATF4、ACSL4和CCL2在调节巨噬细胞功能方面发挥重要作用,而PDIA3在巨噬细胞中的作用尚未明确。PDIA3属于蛋白质二硫异构酶(protein disulfide isomerase,PDI)家族,具有异构酶和氧化还原活性,参与未折叠蛋白反应。然而,PDIA3在肥胖及其发病机制中的作用仍未可知。
研究团队探讨了PDIA3作为人肥胖生物标志物的可行性,并通过饮食诱导的肥胖(DIO)模型、整体代谢指标监测、骨髓移植、单核细胞过继、多重转录组测序、蛋白质谱、染色质沉淀、报告基因及定点突变等实验,发现其作为效应分子调节iMAM功能,从而加剧高脂饮食诱导的肥胖。
在机制层面,研究团队揭示PDIA3主要影响巨噬细胞的活化和趋化活性,巨噬细胞中敲除PDIA3可保护小鼠在高脂饮食诱导下的肥胖和相关代谢紊乱症状。具体而言,在代谢应激条件下,ATF4作为主转录因子促进PDIA3的表达。PDIA3调节RhoA活性,并通过Hippo-YAP信号通路促进巨噬细胞的活化。该研究利用纳米材料结合siRNA靶向巨噬细胞,发现PDIA3作为肥胖免疫干预靶点,具有广泛的临床转化潜力。
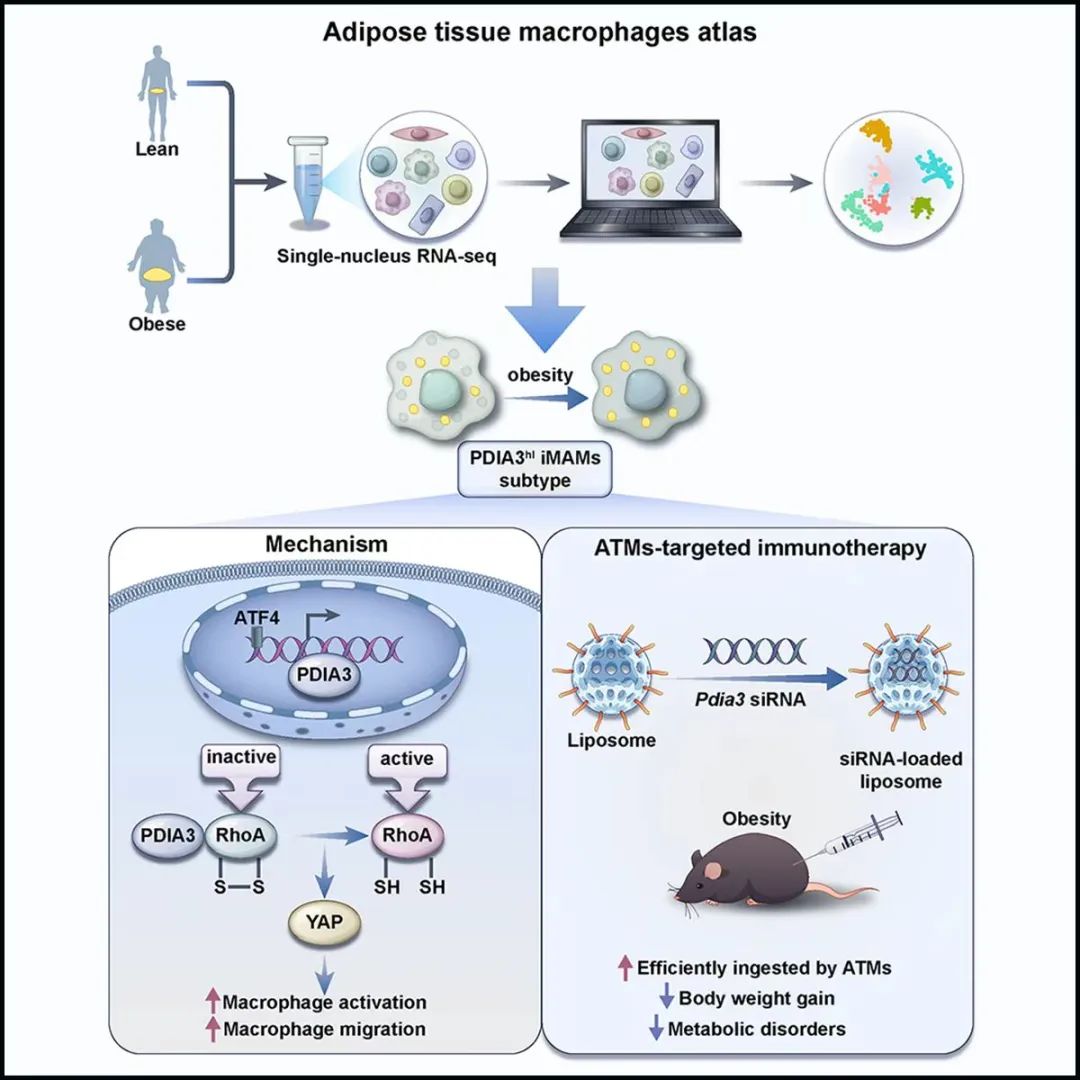
综上所述,该研究揭示了在肥胖个体中的一类新型的ATM亚群,即ATF4hi PDIA3hi ACSL4hi CCL2hi炎症和代谢激活巨噬细胞(iMAM)在肥胖中的作用及其相关机制,系统阐述了效应分子PDIA3在肥胖及其发病机制中的关键作用。研究证明分泌型PDIA3是反映肥胖代谢性炎症程度的可靠标志物,靶向抑制PDIA3有望成为治疗肥胖等代谢性疾病的新靶点。
华中科技大学同济医学院附属同济医院王从义教授和孙飞助理研究员为论文共同通讯作者。华中科技大学同济医学院附属同济医院骆佳卉博士后为论文第一作者。课题组王发席博士后(现就职于武汉大学人民医院)、课题组研究生赵嘉伟、杨春良、荣善杰博士也对本研究做出了重要贡献。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


