研究实现活细胞膜蛋白动力学精密测量
来源:物理所 2021-01-21 12:40
细胞膜既是保护细胞的重要屏障,也是细胞与外界物质和信息交换的界面。空间总厚度约为10纳米的细胞膜(含突出于细胞膜两侧的膜蛋白结构)可被视为准二维凝聚相体系。磷脂双层膜及镶嵌于膜上的众多蛋白质,整体上具有“多重界面复杂流体”的行为和特征。膜本身的二维流动性和三维起伏涨落为膜蛋白动力学的精密测量造成干扰。膜蛋白动力学的实时精密测量,是膜生
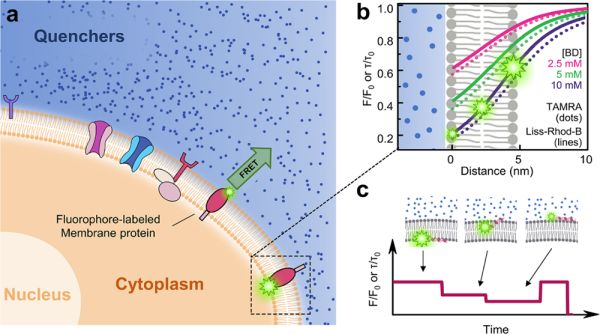
细胞膜既是保护细胞的重要屏障,也是细胞与外界物质和信息交换的界面。空间总厚度约为10纳米的细胞膜(含突出于细胞膜两侧的膜蛋白结构)可被视为准二维凝聚相体系。磷脂双层膜及镶嵌于膜上的众多蛋白质,整体上具有“多重界面复杂流体”的行为和特征。膜本身的二维流动性和三维起伏涨落为膜蛋白动力学的精密测量造成干扰。膜蛋白动力学的实时精密测量,是膜生物物理领域的具有挑战的问题。近年来,为解决这一难题,中国科学院物理研究所SM4组发展出针对体外生物膜模型系统的单分子表面诱导荧光衰逝技术(SIFA)(Nature Communications 7: 12906, 2016)和脂质体包裹荧光悠逝测量技术(lipoFRET)(Angewandte Chemie International Edition 58: 5577, 2019),分别实现了固体表面支撑的二维脂双层膜界面和三维脂质体双层膜界面上的生物大分子跨膜动力学的高精度观测,可直观展现跨膜肽以及膜蛋白等在垂直生物膜方向上的动态过程,并由此获取了相关生物大分子在跨膜过程中的关键动力学信息,为在分子层面揭示生物膜界面跨膜输运的动力学机理奠定重要基础。上述“干净”的物理模型系统,未能有效应用于复杂的活细胞膜研究。活细胞中的生物界面体系组分更为复杂,蕴含着更加丰富且重要的生命过程。
近日,中国科学院物理研究所/北京凝聚态物理国家研究中心软物质物理实验室博士生侯文清、博士后马东飞和贺小龙等在副研究员陆颖和研究员李明的指导下,以前序发展的高精度物理测量方法为基础,发展了专门针对活细胞膜界面膜蛋白动力学测量的高精度方法,进而对其机理进行深入研究。该方法命名为细胞外环境填充荧光受体的荧光共振能量转移(FRET with quenchers in extracellular environment,简称queenFRET)。该方法应用单点对多点的荧光分子间共振能量转移(FRET)原理,通过测量荧光标记分子的荧光强度或荧光寿命,可精确观察标记位点的插膜深度随时间的变化。该方法以好于1纳米(约等于细胞膜总厚度的十分之一)的精度探测细胞膜上单个膜蛋白的动力学。这是迄今为止检测活细胞膜单个蛋白沿膜法线方向运动的最高精度。应用这一方法,可解决以往蛋白质与膜相互作用研究中的问题,包括膜蛋白的跨膜动力学、膜蛋白拓扑结构的动态转变及细胞信号感知与响应等。
细胞膜结构极其复杂。细胞膜上生物大分子的动力学,有些是由其自身的特征和功能决定,有些是由与其相互作用的其他蛋白质决定。三项技术联用,可以解决这个二选一的难题。例如,如果是前者,那么在活细胞膜上表现出来的动力学,亦可以在“干净”的模型系统中观察到。如果是后者,则只能在真实膜系统中观察到。研究人员可以通过在模型系统中融合潜在相互作用对象的方式,找出决定该蛋白动力学性质的其他生物大分子。以上系列测量方法的优势是无须改变生命科学实验室普遍采用的商业荧光显微镜的结构和运行模式,便于推广。对膜上的生物大分子进行荧光标记后,针对不同的研究对象,可采取不同的观察策略。既可以用全内反射荧光显微镜又可以用共聚焦荧光寿命显微镜对目标进行有效观察:基于全内反射荧光显微镜可以观察贴壁细胞;基于共聚焦荧光寿命显微镜可以观察不能贴壁的悬浮细胞。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


