中山大学研究者们揭示了纳米粒介导的lncBCMA沉默促进eEF1A1泛素化并抑制乳腺癌生长和转移
来源:生物谷原创 2023-09-12 13:28
随着医学技术的快速发展,多年来癌症的诊断和治疗取得了巨大的成就。然而,转移仍然发生在许多癌症患者中,并占癌症相关死亡的90%。
随着医学技术的快速发展,多年来癌症的诊断和治疗取得了巨大的成就。然而,转移仍然发生在许多癌症患者中,并占癌症相关死亡的90%。在过去的十年里,尽管由于早期诊断的快速发展,癌症患者的存活率得到了显著的提高,但在转移性癌症的治疗方面却取得了有限的成就。
目前,化疗和靶向治疗仍是转移性癌症患者的一线治疗方式。然而,耐药性和严重的毒副作用严重制约了治疗结果。因此,了解肿瘤转移的生物学过程,找出导致肿瘤转移的关键调控因子,对于制定有效的治疗策略至关重要。

图片来源:https://doi.org/10.1016/j.apsb.2022.12.004
近日,来自中山大学的研究者们在Acta Pharmaceutica Sinica B杂志上发表了题为“Nanoparticles (NPs)-mediated lncBCMA silencing to promote eEF1A1 ubiquitination and suppress breast cancer growth and metastasis”的文章,该研究揭示了纳米粒介导的lncBCMA沉默促进eEF1A1泛素化并抑制乳腺癌生长和转移。
长非编码RNA(LncRNAs)在肿瘤转移中起重要作用。探索转移相关的lncRNA,开发有效的体内靶向调控lncRNA功能的策略,对于转移性肿瘤的治疗至关重要,但这仍然是一个巨大的挑战。
在本研究中,研究者发现了一种新的功能性lncRNA(记为lncBCMA),它可以通过拮抗真核细胞翻译延长因子1A1(EEF1A1)的泛素化来促进三阴性乳腺癌(TNBC)的生长和转移,从而稳定其表达。
基于这一调控机制,设计了一种可用于系统递送lncBCMA siRNA(SiBCMA)的内体pH响应型纳米颗粒(NP)平台。这种NPs介导的siBCMA可以有效地沉默lncBCMA的表达,促进eEF1A1的泛素化,从而显著抑制TNBC肿瘤的生长和转移。这些结果表明,lncBCMA可作为预测TNBC患者预后的潜在生物标志物,NPs介导的lncBCMA沉默可能是转移性TNBC治疗的一种有效策略。
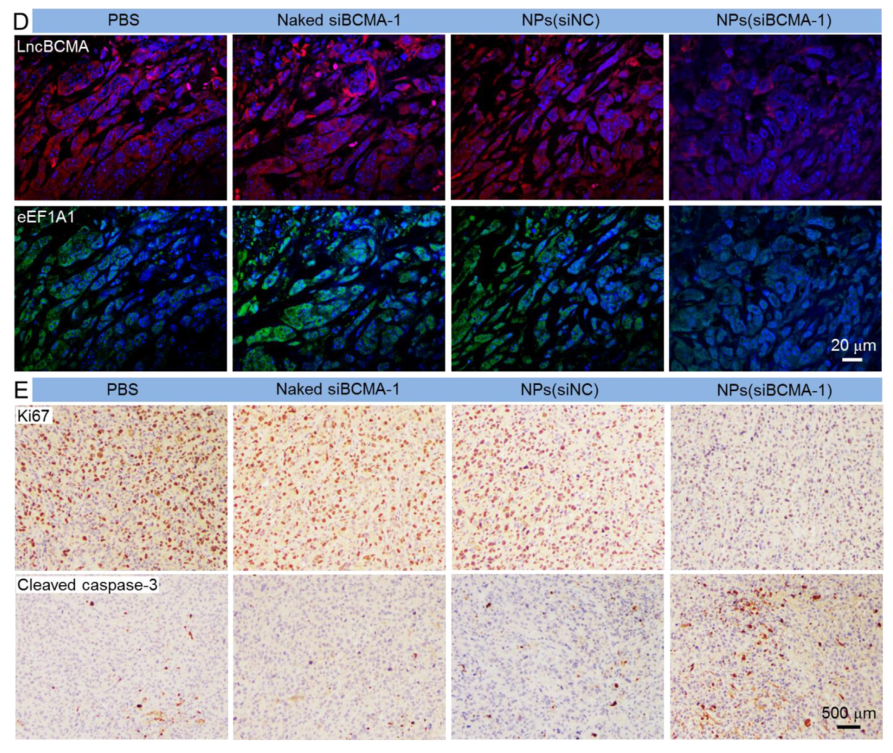
NPS介导的LncBCMA沉默抑制PDX肿瘤模型中TNBC的生长和转移
图片来源:https://doi.org/10.1016/j.apsb.2022.12.004
综上所述,我们发现了一种新的具有功能的lncRNA(即lncBCMA),它在调节TNBC肿瘤的生长和转移中发挥重要作用。分子机制研究表明,该lncRNA可以通过拮抗其泛素化来稳定eEF1A1的表达,从而促进TNBC细胞的增殖、迁移和侵袭。
利用胞体pH响应型纳米粒体内携带siBCMA,可以有效地抑制lncBCMA的表达,促进eEF1A1泛素化,从而显著抑制肿瘤的生长和转移。NncBCMA可用于预测TNBC患者的预后,NPs介导的lncBCMA沉默可能是治疗转移性TNBC的一种有前途的策略。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


