《细胞研究》:一定要好好睡觉啊!湘雅团队发现全新激素,睡眠不足会抑制激素表达,导致胃口大开、食量大增、体重大涨
来源:奇点糕 2025-03-03 10:03
这个研究发现了一个新的、受睡眠调节的下丘脑激素Raptin,并揭示了Raptin抑制食欲和肥胖的分子机制,从而为肥胖的治疗提供了一条潜在的新思路。
大约3年前,妙佑医疗国际(Mayo Clinic)的研究人员在顶刊JACC上发表了一项重磅临床研究成果。
他们发现,仅两周的睡眠限制,就可以让受试者多吃17%的热量(但能量消耗没有变化),这会使得受试者内脏脂肪增加11%[1]。
难怪失眠或者上夜班的人那么容易胖。吃得多了,能量消耗却没有增加,不长肉才怪呢!
然而,三年前的那个研究也留下了一个巨大的疑问:为何睡眠不好,胃口却大好?
今年春节期间,由中南大学湘雅医院罗湘杭和彭慧领衔的研究团队,在著名期刊Cell Research上发表了一篇重磅研究论文[2]。
他们发现了一种新型的下丘脑激素——Raptin,它的水平受睡眠的影响。睡眠质量好的话,Raptin表达水平就高,通过作用于下丘脑室旁核和胃部表达GRM3受体的神经元,一方面抑制食欲,另一方面还抑制胃的排空,进而达到降低食欲、减少进食、防控肥胖的效果。反之,睡眠不好,Raptin表达受抑制,就会胃口大开、食量大增、体重暴涨。
在GLP-1受体激动剂大红大紫的今天,Raptin的发现,以及Raptin受体激动剂的研发,让人充满期待。中南大学湘雅医院谢灵祁和胡彪是论文共同第一作者。

▲ 论文首页截图
研究一开始,罗湘杭团队就利用碎片化睡眠(SF)小鼠模型证实,两个月的碎片化睡眠会加速小鼠体重增加,并增加食物摄入量;而且,与对照组相比,能量的消耗确实没有显著变化。
这一实验结果,再次将矛头指向了热量摄入增加。因此,他们开始着手寻找受睡眠影响的食欲调节激素,下丘脑(神经内分泌系统和睡眠/觉醒周期调节的中心枢纽)成为了他们的研究对象。
蛋白组学分析结果表明,碎片化睡眠小鼠有9个蛋白的水平发生了显著变化,其中有3个是分泌蛋白,而唯独RCN2主要在下丘脑中表达。因此,RCN2就成为他们研究的焦点。后续的荧光标记实验也表明,RCN2主要在下丘脑室旁核(PVN)的神经元中表达。
在分析不同时间段小鼠PVN中RCN2表达水平时,罗湘杭团队发现,与活动期(ZT12和ZT18)相比,睡眠期(ZT0和ZT6)PVN中RCN2表达水平更高。显然,RCN2的表达受睡眠调节。由于PVN是下丘脑激素释放的关键区域,他们推测RCN2可能是一种新型的下丘脑激素,并将其命名为Raptin。
在分析小鼠血浆中Raptin水平之后,他们也发现Raptin的分泌峰值出现在睡眠期(ZT0-ZT12)。基于人体组织的数据也显示,RCN2确实在人PVN神经元中高表达,而且血浆Raptin的峰值出现在睡眠期,尤其是凌晨1点左右。
很显然,在小鼠和人体内,Raptin的表达水平都是受睡眠调节的。
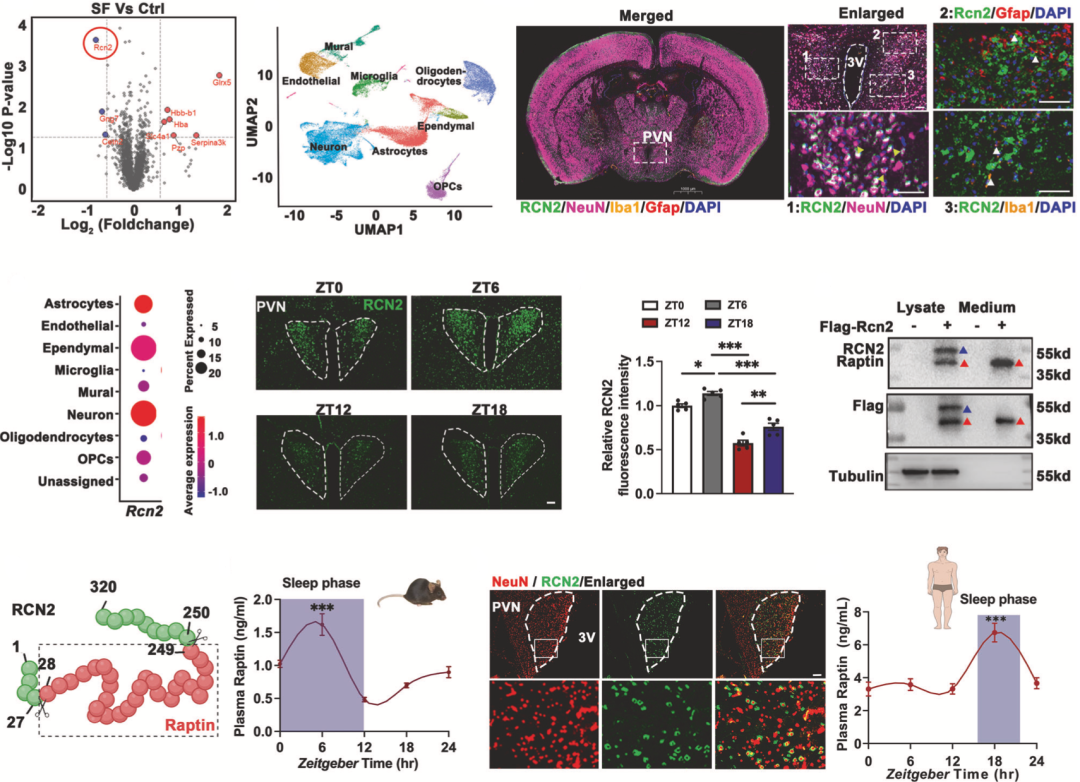
▲ 下丘脑激素Raptin的表达部位,以及与睡眠之间的关系
既然已经抓到了表达Raptin的神经元,接下来要做的,就是找到影响这些神经元,以及受Raptin影响的神经元、组织或器官。
借助于逆行追踪技术,罗湘杭团队发现,下丘脑视交叉上核(SCN)中表达加压素(AVP)的神经元(SCNAVP),是PVN中RCN2阳性神经元(PVNRCN2)的上游信号来源。
具体来说,激活SCNAVP,PVNRCN2也被激活,Raptin水平升高,还能有效降低1小时的食物摄入量;相反,SCNAVP被抑制,PVNRCN2活性也降低,Raptin水平降低,小鼠食物摄入量增加。显然,Raptin的表达水平是由SCNAVP→PVNRCN2这条神经回路调控的。
为了证实Raptin的作用,罗湘杭团队在碎片化睡眠小鼠模型的PVN中过表达了Raptin,发现可以显著缓解小鼠模型体重增加过快的情况,并将小鼠模型的食物摄入量降至对照组水平。此外,PVN特异性Rcn2过表达还能改善碎片化睡眠诱导的葡萄糖耐量、胰岛素敏感性和脂肪积累受损。
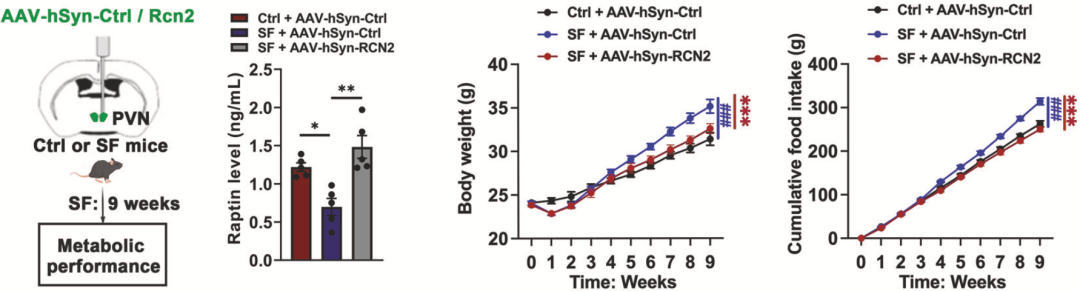
▲ 过表达Raptin的好处
后续体内注射Raptin的研究还表明,Raptin对食欲和胃排空有抑制作用,以及食物摄入量的减少是Raptin诱导体重减轻的主要因素。
此外,基因敲除实验还显示,RCN2不会影响其他典型食欲调节神经元(例如抑制食欲的POMC表达神经元和促进进食的AgRP表达神经元),也不影响瘦素和食欲素A的水平。
简而言之,源自下丘脑的Raptin能抑制食物摄入,并预防肥胖,而且与其他多种调节方式保持独立关系。
接下来的问题是,受睡眠调节的下丘脑激素Raptin,究竟是如何调节食欲的呢?
罗湘杭团队先确定了Raptin的受体是GRM3,以及Raptin主要靶向PVN和胃神经元上表达的GRM3。这说明,下丘脑室旁核(PVN)和胃是Raptin的主要靶组织/器官。
无论是特异性敲除PVN神经元中的Grm3基因(增加食欲),还是特异性敲除胃神经元中Grm3基因(加速胃排空),都会增加小鼠的进食量和体重。如果同时敲除上述两处神经元的Grm3基因的话,小鼠的进食量和体重增加更多,说明两个靶器官的功能并不重叠,后续研究也证实,其实这两个靶器官的反应不存在关联。
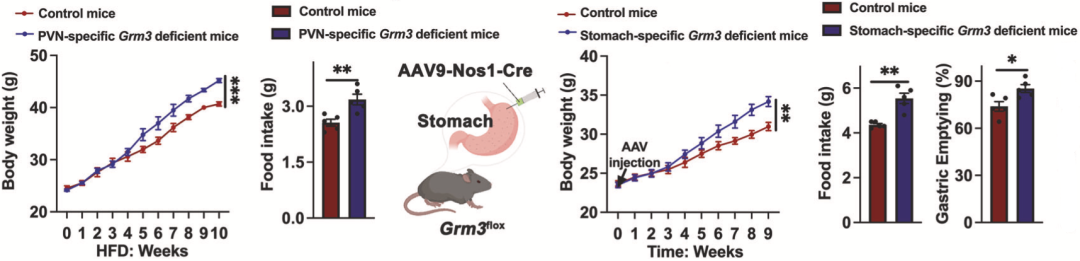
▲ 下丘脑室旁核(PVN)和胃是Raptin的主要靶组织/器官
至于下丘脑激素Raptin激活下游神经元的机制,罗湘杭团队也做了探索。
他们发现,Raptin-GRM3信号激活了PI3K-AKT通路,启动了线粒体轴突运输,为神经元活动的维持,提供了充足的能量。
罗湘杭团队这个研究的另一大亮点,是在人体内初步探索了Raptin的作用机制。
他们基于近300名受试者的数据发现,Raptin水平失调与睡眠不足诱发的肥胖症有关。此外,他们还证实,睡眠限制疗法(SRT)不仅可以改善受试者的睡眠质量,还可以降低体重、减少能量摄入,提升血浆Raptin水平。
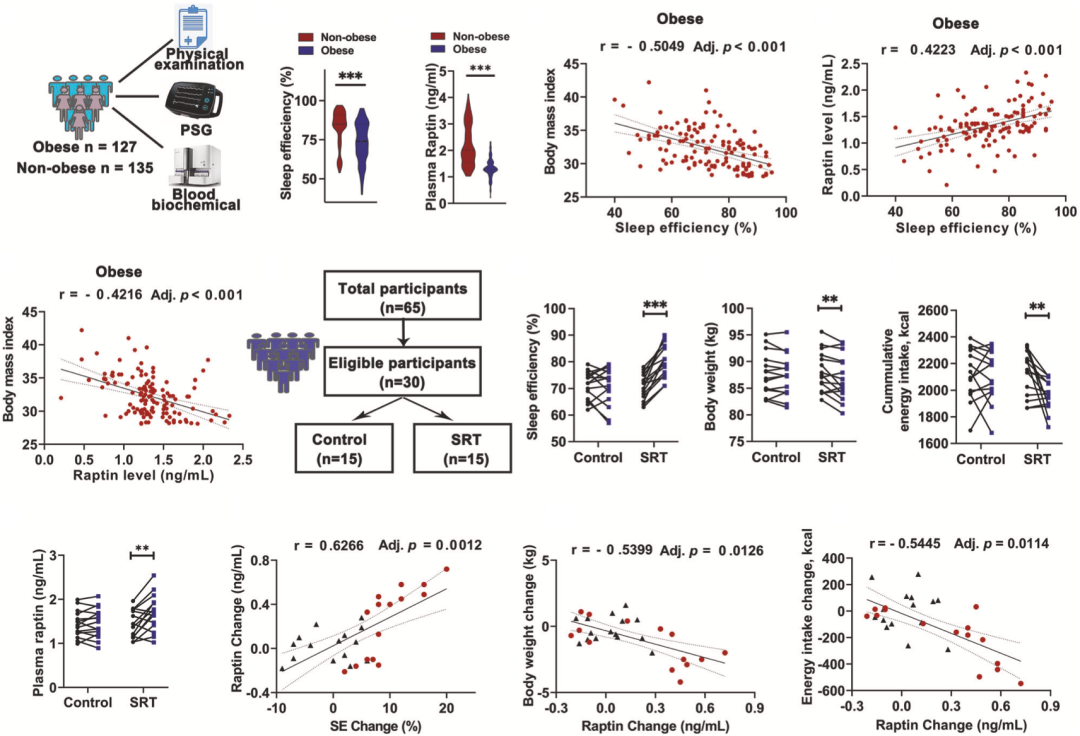
▲ 人体研究数据
研究的最后,他们分析了我国2000名肥胖症患者的基因数据,发现了一个RCN2的无义突变(p.Arg157Ter)。
三名携带该突变的肥胖症患者都患有夜食综合征(NES),他们在夜间睡眠阶段的血浆Raptin水平较低,夜间食物摄入量显著增加。
总的来说,罗湘杭/彭慧团队这个研究发现了一个新的、受睡眠调节的下丘脑激素Raptin,并揭示了Raptin抑制食欲和肥胖的分子机制,从而为肥胖的治疗提供了一条潜在的新思路。鉴于GLP-1受体激动剂那么火,Raptin受体激动剂非常值得研究。
参考文献:
[1].Covassin N, Singh P, McCrady-Spitzer SK, et al. Effects of Experimental Sleep Restriction on Energy Intake, Energy Expenditure, and Visceral Obesity. J Am Coll Cardiol. 2022;79(13):1254-1265. doi:10.1016/j.jacc.2022.01.038
[2].Xie LQ, Hu B, Lu RB, et al. Raptin, a sleep-induced hypothalamic hormone, suppresses appetite and obesity. Cell Res. Published online January 29, 2025. doi:10.1038/s41422-025-01078-8
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


