Hepatology: ALK1控制遗传性出血性肝毛细血管扩张症
来源:生物谷原创 2022-07-18 10:33
该研究证实了肝内皮细胞ALK1信号保护器官特异性内皮细胞分化和血管分泌信号,防止血管畸形的发生。
遗传性出血性毛细血管扩张症(HHT)是一种常染色体显性遗传病,可导致多器官血管畸形。HHT最常见的症状是鼻出血、毛细血管扩张和内脏损害。HHT的患病率较低,为1:5000,因此,诊断通常会延迟多年。
复发性鼻出血影响约90%的HHT患者,是最常见和最明显的主诉。然而,肝脏等内部器官的畸形和分流与长期预后更相关,因为它们最终可能导致心力衰竭。
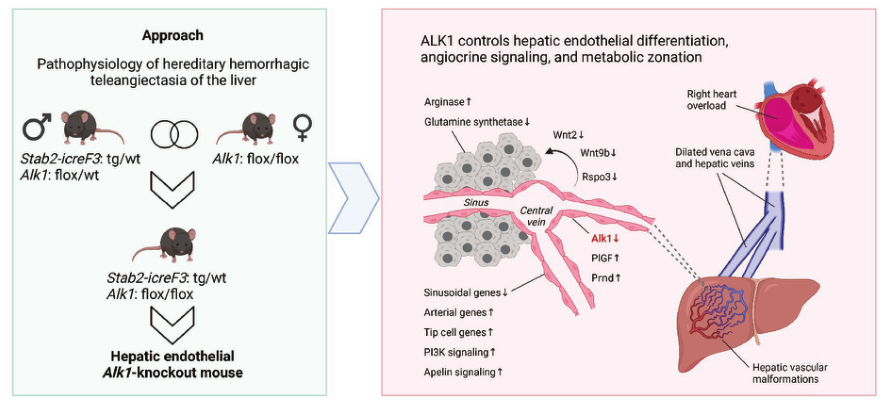
在遗传性出血性毛细血管扩张症(HHT)中,严重的肝血管畸形与编码ALK1的激活素A受体样1型(ACVRL1)基因突变有关,ALK1是BMP9/BMP10的受体,调节血管发育。在这里,研究者建立了一种新的HHT小鼠模型,该模型只涉及肝脏,并具有足够的预期寿命,以研究ALK1信号在肝脏血管形成和代谢功能中的作用。

图片来源: https://pubmed.ncbi.nlm.nih.gov/35776660/
近日,来自莱顿大学医学中心的研究者们在Hepatology杂志上发表了题为“ALK1 controls hepatic vessel formation, angiodiversity, and angiocrine functions in hereditary hemorrhagic telangiectasia of the liver”的文章,该研究证实了肝内皮细胞ALK1信号保护器官特异性内皮细胞分化和血管分泌信号,防止血管畸形的发生。长期存活的Alk1HEC-KO HHT模型为开发这种严重疾病的靶向治疗提供了新的机会。
研究者将肝窦内皮细胞(LSEC)选择性Cre缺失品系Stab2-iCreF3与Acvrl1-Flobled小鼠杂交,获得LSEC特异性Acvrl1缺陷小鼠(Alk1HEC-KO)。Alk1HECKO小鼠表现出肝脏血管畸形和肝后血流增加,导致右室容量超负荷。
转录学分析表明,在LSEC和中心静脉同一性的代价下,诱导了前血管生成/TIP细胞基因组和肝血管的动脉化。LSEC血管因子Wnt2、Wnt9b和Rspo3的缺失导致了Alk1HEC-KO小鼠和HHT患者肝脏标本中代谢肝区带的破坏。
此外,在Alk1HEC-KO肝内皮细胞中,PrND和胎盘生长因子(PGF)表达上调,代表了HHT器官特异性发病的新候选基因。在LSEC体外,刺激或抑制ALK1信号反向调节DNA结合抑制物(ID)1-3,已知的Alk1转录靶点。对ALK1信号的刺激和对ID1-3功能的抑制证实了BMP9/ALK1/ID轴对WNT2和Rsp3的调节。
机制总结图
图片来源: https://pubmed.ncbi.nlm.nih.gov/35776660/
本研究的小鼠HHT模型与人类疾病之间的显著相似性证实了Alk1HEC-KO小鼠是研究HHT在肝脏中的发展以及在疾病发展的不同阶段开发和验证新的治疗策略的有价值的工具。在HHT晚期,由于肝脏分流和容量超负荷,心力衰竭是一种严重的并发症,这也反映在研究者HHT模型中。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


