黑磷纳米片对恶性胶质母细胞瘤治疗方面的研究取得最新进展
来源: 中山大学 2024-02-04 10:34
中山大学邓文斌团队发现BPNS具有抑制GBM细胞侵袭迁移的生物活性,并进一步探索BPNS影响GBM细胞侵袭迁移的内在机制。
长期以来,胶质母细胞瘤(glioblastoma,GBM)的治疗一直是医学领域的一个重要挑战。由于该类肿瘤的高度侵袭性和恶性程度,使得其对传统治疗方法的反应较差,因此寻找更有效的治疗手段成为迫切的需求。在过去的几年里,一些研究集中于利用纳米技术来改善胶质瘤的治疗效果。其中,黑磷纳米片(Black phosphorus nanosheets,BPNS)作为一种新兴的纳米材料引起了广泛关注,它不但具有良好生物相容性以及抑制肿瘤细胞增殖的生物活性,还能在近红外光的作用下穿过血脑屏障,这使得它有望成为治疗胶质母细胞瘤的候选方式。
中山大学邓文斌团队在Chemical Engineering Journal上发表了题为“Black phosphorus nanosheets inhibit glioblastoma cell migration and invasion through modulation of WNT/β-catenin and NOTCH signaling pathways ”的文章。研究团队发现BPNS具有抑制GBM细胞侵袭迁移的生物活性,并进一步探索BPNS影响GBM细胞侵袭迁移的内在机制。
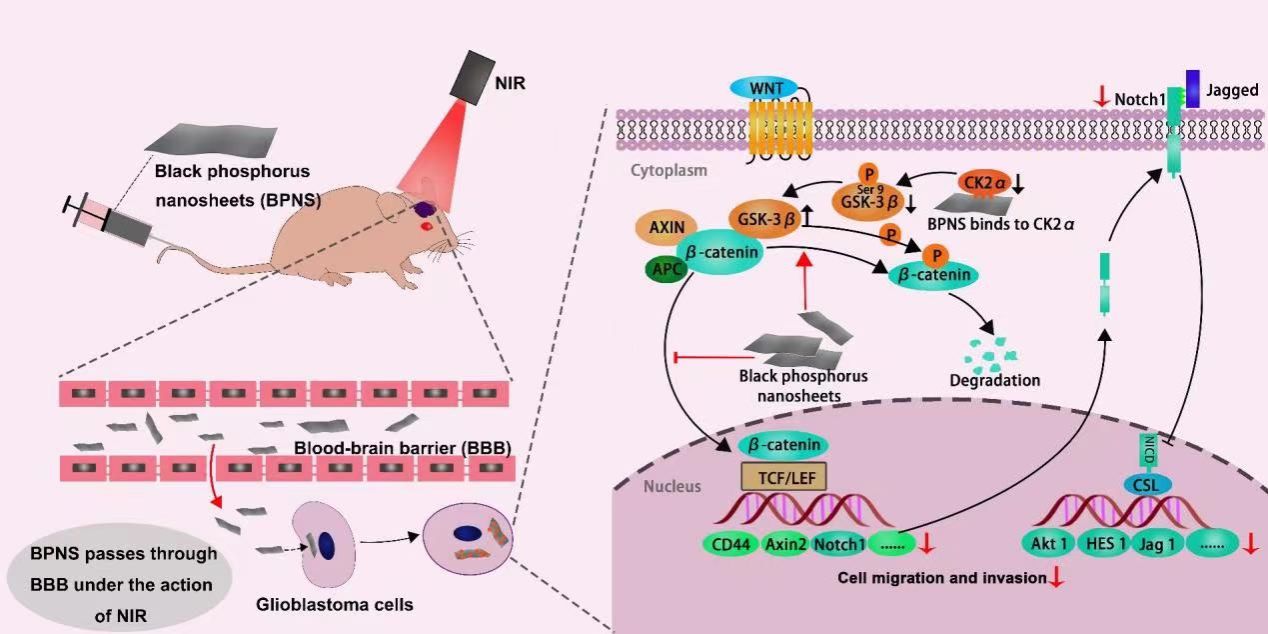
研究机制示意图
在这项研究中,该团队探究了BPNS对GBM细胞的影响,并观察到BPNS能明显地抑制GBM细胞的侵袭和迁移,且呈剂量依赖性。RNA测序分析不仅佐证了BPNS具有抑制GBM细胞侵袭迁移的生物活性,还指出了与侵袭和迁移相关的WNT/β-catenin和NOTCH信号通路或许是BPNS抑制胶质母细胞瘤细胞侵袭迁移的内在机制。实验结果表明,BPNS直接结合到激酶CSNK2A2上,降低CSNK2A2的活性,从而增加GSK-3β的活性。GSK-3β的活性增加促进WNT/β-catenin信号通路中β-catenin的降解,导致WNT/β-catenin信号通路的抑制,以及该信号通路关键下游基因Axin2,CD44和Notch1的下调。Notch1基因水平的下调抑制了NOTCH信号通路,并进一步下调下游关键基因Jag1,Hes1和Akt1。BPNS对两条信号通路的抑制,使其具备了抑制GBM侵袭迁移的生物活性。总体而言,这项研究揭示了BPNS对GBM细胞侵袭和迁移的抑制作用,并揭示了其潜在的分子机制,为未来的GBM治疗提供了潜在途径,也为BPNS在生物医药领域的应用打开了新的思路。
该论文的第一作者为中山大学药学院(深圳)博士研究生熊月,通讯作者为中山大学药学院(深圳)邓文斌教授。该研究得到了国家自然科学基金、深圳市科技计划孔雀团队项目和广州市创新科技基金的大力支持。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


