“诺奖风向标”拉斯克奖出炉,相分离研究先驱获奖,他们阐明了低复杂度结构域的结构和功能
来源:生物世界 2025-09-13 15:49
刚刚,2025 年拉斯克奖获奖名单出炉,6 位科学家分别获得拉斯克基础医学奖、拉斯克临床医学奖、拉斯克特别成就奖。
拉斯克奖(Lasker Awards )是美国最具声望的生物医学奖项,也是医学界仅次于诺贝尔奖的一项顶级大奖,该奖项创立于1946年,旨在表彰医学领域作出突出贡献的科学家、医生和公共服务人员。
拉斯克奖素有“诺奖风向标”之称,例如,屠呦呦;Katalin Karikó 和 Drew Weissman;Demis Hassabis 和 John Jumper 等人都在获得拉斯克奖不久后获得了诺贝尔奖。
刚刚,2025 年拉斯克奖获奖名单出炉,6 位科学家分别获得拉斯克基础医学奖、拉斯克临床医学奖、拉斯克特别成就奖。
拉斯克基础医学奖——低复杂度结构域的结构与功能
获奖者:Dirk Görlich(马克斯·普朗克研究所)、Steven L. McKnight(德克萨斯大学西南医学中心)
获奖理由:对于揭示蛋白质序列中低复杂度结构域的结构和功能的发现,这些发现阐明了细胞内运输和细胞组织的新原理。
Dirk Görlich 和 Steven L. McKnight 凭借大胆的想象力和巧妙的实验,揭示了细胞内运输和细胞组织的新原理。教科书通常强调蛋白质的结构复杂性和化学精妙性,突出其独特的三维结构,这些结构使这些分子能够执行专门的任务。它们的多样性源于氨基酸的排列顺序,每个氨基酸都赋予其独特的特性。按照这种传统观点,低复杂度结构域(LCD)仅由少数几个氨基酸组成,而非组成蛋白质的全部 20 种氨基酸,因此它们摇摆不定,几乎无法执行重要任务。然而,大约 15%-20% 的真核生物蛋白质包含这样的结构域,他们的研究表明,这些“无序”的 LCD 在细胞内聚集,支持多种生理功能。
破解细胞核运输悖论
真核细胞拥有众多膜包被的区室,用于收集执行不同功能的机制。这些细胞中,膜将细胞核内的物质与细胞质隔开。分子通过高度选择性的运输系统在区室之间移动,该系统依赖于核孔复合体。这些蛋白质通道穿透核膜,在其中形成通道,使核-质交换得以发生。
到 21 世纪初,物质进入细胞核的关键特征已显现出来——小分子无需帮助就能穿过核孔,但大分子则不行,大分子的通过需要转运蛋白。在做博士后期间,Dirk Görlich 发现了其中一种转运蛋白——这是已知的第一个能帮助蛋白质从细胞质穿过核孔进入细胞核的因子。
科学家们知道,转运蛋白还会与填充孔道中心通道的蛋白质(核孔蛋白)相互作用,它们含有低氨基酸复杂度的区域,其间散布着由苯丙氨酸(F)和甘氨酸(G)组成的二肽基序。此外,这些低复杂度结构域(LCD),即所谓的“FG 重复序列”,无论是否携带货物,都能促进转运蛋白的转运。然而,其机制却一直不为人知。
这些观察结果引发了难题——尽管与转运蛋白结合后的复合物比单独的货物更大,但与转运蛋白结合却加快了货物进入细胞核的速度。
2001 年,Dirk Görlich 利用带有荧光标记的转运蛋白及其所携带的蛋白质来测量从细胞质向细胞核的流入量。该研究证明了,核孔蛋白复合体能够以极高的容量和速度运送转运蛋白——无论其是否携带货物,这一速度远超此前预期。这让他对这种高效性感到惊叹,但他对大多数分子进入细胞核受到何种限制,以及转运蛋白如何克服这一障碍仍感到困惑。
Dirk Görlich 构想了一个模型——核孔蛋白的低复杂度结构域(LCD)由于含有大量苯丙氨酸而具有疏水性,这些区域相互抓取以尽量减少与水的接触,只有当大分子克服了这种排斥力时,它们才能穿过疏水壁(下图A)。
Dirk Görlich 提出,转运蛋白与核孔蛋白的 LCD 结合,从而与重复序列间的相互作用竞争;因此,LCD 中的氨基酸彼此脱离,转而与转运蛋白结合。通过这种方式,转运蛋白融入网格,网格围绕着迁移的实体密封起来,即使通道内有大分子,也能阻止其他大分子通过。当转运蛋白穿梭于核孔时,其后的疏水键重新结合。这种“选择性溶解”解释了转运蛋白的促进作用以及对无法进入核孔蛋白筛网的分子的阻断作用。渗透性和屏障机制本质上是相互关联的。他开始着手探究这一富有远见的方案。
一种假说逐渐成形
次年,Dirk Görlich 报告称,转运蛋白具有异常的疏水性,破坏核孔的疏水性会使核孔打开。这些进展证实了疏水性对分选的影响,但并未直接证明他所假定的核孔内物质的存在。他仅提取出了一种著名核孔蛋白的 LCD,然后,在特定条件下,令人惊喜且兴奋的事情发生了——它凝固成了半透明凝胶,正是他所预测的那种物质状态。通过基因工程,他将每个苯丙氨酸都替换成了非疏水性的丝氨酸,结果得到的蛋白质仍呈液态,这表明疏水性有助于凝胶的形成。
这种凝胶模拟了核孔的选择性。它将那些自身无法通过孔隙的测试蛋白拒之门外,却能让多种转运蛋白穿透并扩散其中。除非与转运蛋白结合,否则一个大分子货物蛋白几乎完全被阻挡在外。这些结论结果分别于 2006 年和 2007 年发表,但仍有疑问存在。尤其是,没有人证实通过完整核孔复合体的转运依赖于含 LCD 的核孔蛋白之间的相互作用——而这恰恰是 Dirk Görlich 提出的模型的核心要素。因此,他想在真实的核孔复合体背景下仔细审视这些想法。
Dirk Görlich 从蛙卵提取物中重新构建了核孔,并于 2012 年证明了核孔通透性屏障需要富含苯丙氨酸的重复序列之间的疏水相互作用。这些实验支持了他的假设,并排除了当时其他主要理论。
三年后,Dirk Görlich 报告称,在多种生物(包括动物、植物、真菌和原生生物)中发现的一种核孔蛋白的 LCD 会自发地聚集形成密集颗粒,从而为转运蛋白及其货物提供通道。这些漂浮的核孔类似于细胞内暂时形成的液滴,发挥着至关重要的作用。
2021 年,Dirk Görlich 在 Nature Communications 期刊发表了一篇精妙且有力的文章,为他的核孔研究画上了圆满句号。在这篇文章中,他证明了一种含有 FG 重复序列的简单合成蛋白能够重现选择性核输入,他将物质向细胞和组织转运的屏障的本质提炼出来——仅用一段 12 个氨基酸的 LCD 序列重复 52 次,就产生了最相关的特性。
低复杂度,高影响
Steven L. McKnight 研究的是基因调控,而非核孔,但他注意到了 Dirk Görlich 有关核孔蛋白异常凝胶化的论文。一次偶然的观察使他发现了同类的自组装物质。在寻找一种能刺激胚胎干细胞转化为心肌细胞的化合物的分子伴侣时,他和合作者将这种基于异噁唑的化合物的衍生物与捣碎的细胞混合,结果数百种蛋白质粘在了上面。这一结果起初看起来很糟糕:这种化学物质似乎非特异性地结合了蛋白质。但他注意到,许多被捕获的分子都是存在于 RNA 颗粒中的 RNA 结合蛋白。
一个共同特征凸显出来——每种蛋白质都包含一段低序列复杂度的结构域。与核孔蛋白类似,这些序列仅使用 20 种氨基酸中的几种。几十年前,Steven L. McKnight 就曾与低复杂度结构域(LCD)打过交道,因为在许多蛋白质中,LCD 赋予了激活基因的能力。然而,阐明这些从细胞中提取出来时呈扭曲、无序状态的片段的功能,曾让他感到棘手。如今,他意外地又回到了 LCD 这个课题上。
为了评估 LCD 是否是与异噁唑类化合物关联的基础,他和合作者从几种 RNA 结合蛋白中移除了 LCD 序列,或者将这段序列添加到通常不与该化学物质结合的测试分子上。结果显示, LCD 序列对于结合来说是必要且充分的。在进行这些实验时,他们注意到,一种含 LCD 的蛋白质 FUS 会凝胶化,就像核孔蛋白一样,他于 2012 年在 Cell 期刊发表了这些发现。
Steven L. McKnight 的研究成果立竿见影,因为这些结果精确地阐明了无膜且富含 RNA 的细胞器的形成基础,这种无膜细胞器的行为就像液滴一样,这一现象由 Clifford Brangwynne、Anthony Hyman 和 Frank Jülicher 所报道,2009 年,他们在 Science 期刊发表论文,证实了 Dirk Görlich 的相分离原理适用于一种名为 P-body 的富含 RNA 且无膜的细胞器,并且它们能够迅速溶解和凝聚。他们提出,其他自组装单元可能也依赖于类似的过程,但并未探讨其潜在的分子机制。
Steven L. McKnight 对 LCD 组成的凝胶进行的电子显微镜成像显出长而均匀的纤维,X 射线衍射呈现出所谓交叉 β 关联的典型特征,这种关联是阿尔茨海默病等致病条件下发现的淀粉样纤维的特征。在这种构建策略中,组成蛋白链通过其主链之间的氢键堆叠在一起。然而,与具有非凡韧性的经典淀粉样蛋白不同,FUS 蛋白聚集体在洗涤剂的作用下被分解了。
与此同时,Steven L. McKnight 注意到,异噁唑衍生物会形成一种晶体,其表面呈现出一系列具有独特氢键供体和受体模式的凹槽,能够完美地容纳伸展的蛋白质链。在 2012 年发表的分享这些结果的论文中,他提出 LCD 可能利用细胞内的相关结构聚集形成 RNA 颗粒。在他看来,LCD 之间的必要结合不如凝胶中的结合广泛且持久,但它们具有相同的化学基础。这种可逆的聚集能使功能中心在适当的时候组织起来,并在使用后分解(下图B)。
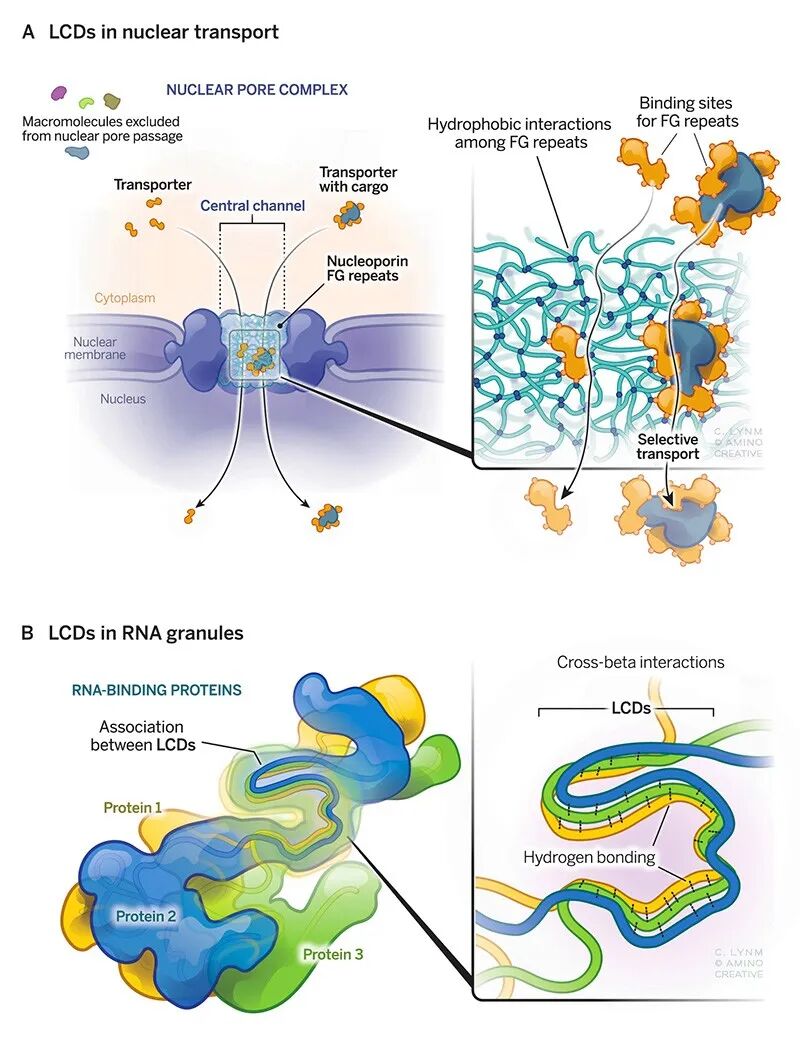
为了使这一设想成立,Steven L. McKnight 证实 LCD 相互作用的生物学相关性。为此,他通过化学修饰暴露部分,在凝胶和哺乳动物细胞的细胞核中对一种 RNA 结合蛋白(hnRNPA2)的 LCD 进行了探究。2015 年,他报告称,该 LCD 在这三种环境中都呈现出相似的结构,包括在液滴中。
为了确定其原子层面的细节,他与美国国立卫生研究院的生物物理学家 Robert Tycko 合作,固态核磁共振光谱显示 FUS 蛋白的 LCD 内存在交叉 β 核心。越来越多的证据表明,LCD 在健康活细胞中通过这些连接相互协作,从而完成关键任务。例如,2021 年,他们展示了细胞骨架成分——中间纤维内的 LCD 在正常组织状态下呈现出这种排列。
弱点的力量
2022 年,通过一种新颖的实验方法,Steven L. McKnight 直接检验了蛋白质主链之间的氢键——这是交叉 β 结构的关键组成部分——是否有助于 LCD 的组装。操纵这种氢键并非易事,因为标准的基因工程方法改变的是侧链,而非主链。他通过化学封端主链中的氮原子来阻断氢键,并测量这一操作是否干扰了 LCD 聚集的能力。他重点关注了 LCD 中对相分离至关重要的一个区域。
这些实验及其他实验确定了蛋白质主链氢键促进相分离的确切位置,从而证实了它们在这一过程中的作用,并进一步支持了细胞内 LCD 相互作用依赖于交叉 β 结构连接的观点,此外,单个氢键就能产生可测量的影响这一观察结果,证实了自关联处于一个可以向任一方向倾斜的阈值之上这一原则。
值得注意的是,脯氨酸无法参与氢键的形成,因为其主链氮原子不具备形成氢键所需的氢原子。Steven L. McKnight 推测,脯氨酸或许能够中断延长的交叉 β 氢键链,从而防止有害的聚集。他想知道,在 LCD 中导致疾病的突变,如果将脯氨酸替换为其他氨基酸,是否能证实这一观点。
为了探究这种可能性,他将注意力集中在基因编码的三种不同蛋白质(神经丝轻链 NFL、tau 蛋白和 hnRNPA2)中脯氨酸被替换的点突变上,这三种突变蛋白质分别会导致三种不同的疾病:遗传性神经疾病 Charcot-Marie-Tooth 病、额颞叶痴呆和 Paget 病。在试管实验中,含有这些突变氨基酸的肽段会聚集,而阻断这些有问题的氨基酸的主链氢键能力则可恢复其正常行为。这些结果表明,突变通过稳定通常可逆的交叉 β 连接来驱动这些疾病的发病机制。
含低复杂度结构域(LCD)的蛋白质之间固有的弱关联带来了巨大的益处。许多生理过程必须能够切换,在适当的时候启动,在条件变化时停止。短暂的相互作用适合于将它们推向一个方向或另一个方向的调控机制。
Steven L. McKnight 和 Dirk Görlich 通过证明蛋白质组中相当一部分(约 15%-20%)具有低复杂度结构域(LCD)的蛋白,能够使细胞构建出灵活且可逆的结构,从而改变了我们对生物学一个基本认知,这些结构超越了传统的膜结合细胞器,对细胞功能进行组织和调节。
获奖理由:他们三人在开发治疗囊性纤维化的新疗法方面发挥了关键作用——这种由三种药物组成的组合疗法拯救了患有这种致命遗传疾病的人的生命。
Michael J. Welsh 阐明了囊性纤维化这种致命遗传疾病背后的蛋白质正常工作原理以及患病者体内该蛋白质的异常表现。这些发现为寻找能够纠正异常蛋白质的小分子药物开辟了可能性。Jesús González 开创了一种用于筛选化学库中潜在化合物的系统,而 Paul A. Negulescu 领导并倡导了囊性纤维化项目,该项目最终研发出一种三联药物组合,将囊性纤维化转变为一种可控制的疾病。
获奖理由:她在生物医学领域 55 年的卓越贡献——发现了细菌如何在时间和空间上协调其遗传逻辑以产生不同的子细胞;创建了斯坦福大学著名的发育生物学系;以及在国家层面的杰出领导力。
Lucy Shapiro 发现了细菌如何在时间和空间上协调其遗传逻辑以生成两个截然不同的子细胞。她创建了斯坦福大学的发育生物学系,并凭借引领其研究的同样独特视野,将其打造成了一个充满原创性问题的杰出机构,这些问题引导着世界级研究人员开展研究工作。她还是一位口才出众、极具说服力的演讲者,她曾就生物战和新兴传染病向几届美国政府提供建议,在国家层面展现了卓越的领导才能。鉴于对抗生素耐药性的担忧,她创办了两家生物技术公司,其新颖的方法已研发出用于人类的药物以及一种能消灭农业害虫的制剂。
拉斯克奖华人获奖者
此前共有 7 位华人科学家荣获拉斯克奖,分别是李卓皓(1962年基础医学奖)、李敏求(1972年临床医学奖)、简悦威(1991年临床医学奖)、屠呦呦(2011年临床医学奖)、卢煜明(2022年临床医学奖)、黄学东(2023年临床医学奖)、陈志坚(2024年基础医学奖)。
李卓皓,获奖理由:分离并鉴定脑垂体前叶中的六种激素。
李敏求,获奖理由:成功化疗治疗了妊娠期绒毛膜癌。
简悦威,获奖理由:开创性地使用重组 DNA 技术诊断人类遗传疾病,包括血红蛋白病。
屠呦呦,获奖理由:发现青蒿素——一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命。
卢煜明,获奖理由:在母体血液中发现胎儿DNA,从而对唐氏综合症进行无创产前检测。
黄学东,获奖理由:发明了光学相干断层扫描技术——OCT,这项技术革新了眼科学,可以快速检测出损害视力的视网膜疾病。
陈志坚,获奖理由:发现感知自身和外源DNA的cGAS酶,解开了DNA如何刺激免疫和炎症反应的谜团。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


