《科学》子刊:破解乳腺癌抗HER2治疗耐药之谜
来源:奇点糕 2022-06-17 11:00
HER2是一种表皮生长因子受体,在20%的乳腺癌中高表达[1],抗HER2治疗已成为HER2高表达乳腺癌患者的标准治疗方案,包括曲妥珠单抗在内的多种抗HER2药物在临床中取得了良好的效果[2]。
HER2是一种表皮生长因子受体,在20%的乳腺癌中高表达[1],抗HER2治疗已成为HER2高表达乳腺癌患者的标准治疗方案,包括曲妥珠单抗在内的多种抗HER2药物在临床中取得了良好的效果[2]。
尽管很大一部分HER2+乳腺癌患者受益于抗HER2治疗,但这些患者中的一部分会产生耐药性[3]。因此,深入探究参与抗HER2治疗应答以及乳腺癌转移的分子机制至关重要,这些认识可能有助于开发更有效的治疗策略。
近期由来自西班牙癌症生物医学研究中心的Pilar Eroles博士与Juan Miguel Cejalvo博士领衔的研究团队在《科学进展》期刊发表研究成果[4],他们发现肿瘤细胞表面受体络氨酸激酶AXL的高表达是HER2+乳腺癌对曲妥珠单抗耐药的重要原因。机制上,AXL通过促进乳腺癌细胞上皮间质转换(EMT)促进其转移,并且与HER2形成异源二聚体激活PI3K/AKT以及MAPK通路。
这项研究成果表明,针对AXL高表达的HER2阳性乳腺癌患者联合使用抗HER2药物与AXL抑制剂或许可以发挥更好的效果,同时也表明AXL可以作为HER2阳性乳腺癌的预后生物标志物。

AXL是受体络氨酸激酶家族成员,其与肿瘤MET相关,并促进肿瘤的存活以及转移,在多种肿瘤中AXL的上调与靶向药物以及化疗耐药相关[5,6]。在乳腺癌中AXL的高表达与肿瘤转移以及不良预后相关[7,8],有研究认为抑制AXL是治疗三阴性乳腺癌的一种有效策略[9],然而AXL在HER2+乳腺癌中的作用仍不清楚。
为了探究AXL的表达与HER2+乳腺癌对曲妥珠单抗耐药之间的关系,研究团队检测了曲妥珠单抗耐药乳腺癌细胞系中AXL的表达,发现相比曲妥珠单抗敏感细胞系,耐药细胞中AXL的表达水平以及磷酸化程度更高。
这提示AXL的表达或许与乳腺癌细胞耐药有一定关系,接下来研究团队通过RNA干扰以及药物抑制两种方式抑制AXL,结果显示抑制AXL后乳腺癌细胞对曲妥珠单抗治疗的响应率显著提高;而过表达AXL后,乳腺癌细胞对曲妥珠单抗的治疗响应率显著降低。这些数据表明AXL能够促进乳腺癌细胞对曲妥珠单抗的治疗抵抗。
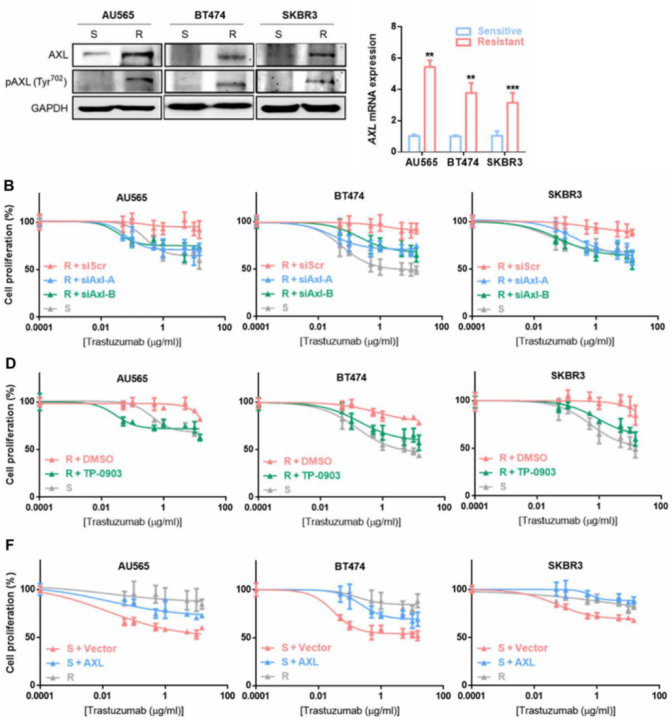
(顶图)耐药细胞中AXL的表达显著升高,(B,D)抑制AXL增加肿瘤细胞对曲妥珠单抗的敏感度,(F)过表达AXL则增强了肿瘤细胞的耐药性
AXL是如何增强乳腺癌的耐药性的呢?
由于EMT是肿瘤耐药以及转移的重要部分,而此前有报道显示AXL与EMT有关,因此研究团队检测了对曲妥珠单抗耐药的乳腺癌细胞中EMT相关基因的表达,发现相比于敏感细胞系,耐药细胞中EMT相关基因表达明显上调;过表达AXL进一步上调了EMT相关基因的表达;而抑制AXL则可以抑制EMT相关基因的表达。这些数据表明AXL可以通过增强肿瘤细胞的EMT促进其耐药。
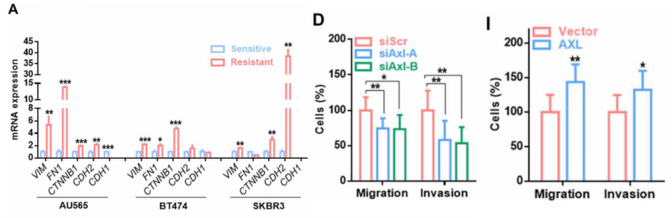
AXL促进肿瘤细胞发生EMT,并增强其迁移能力
之前有报道显示AXL可以通过配体依赖以及配体非依赖两种方式发挥作用[10,11],为了探究在HER2+乳腺癌细胞中AXL发挥作用的方式,研究团队首先检测了乳腺癌细胞中AXL配体GAS6的表达水平,发现不论AXL的表达水平如何,GAS6的表达水平都很低。而免疫共沉淀实验显示AXL与HER2可以形成异源二聚体,这提示AXL发挥作用不依赖于配体GAS6。
接下来研究团队想知道AXL-HER2异二聚体能够激活哪些胞内信号通路,通过Western blot实验发现,与曲妥珠单抗敏感细胞系相比,AXL+的耐药细胞中PI3K/AKT和MAPK/ERK信号通路显著激活,而同时抑制HER2与AXL可以最大限度地抑制这些信号通路。这些数据提示,AXL-HER2二聚化激活了PI3K/AKT和MAPK/ERK信号通路,从而导致曲妥珠单抗治疗效果的降低。
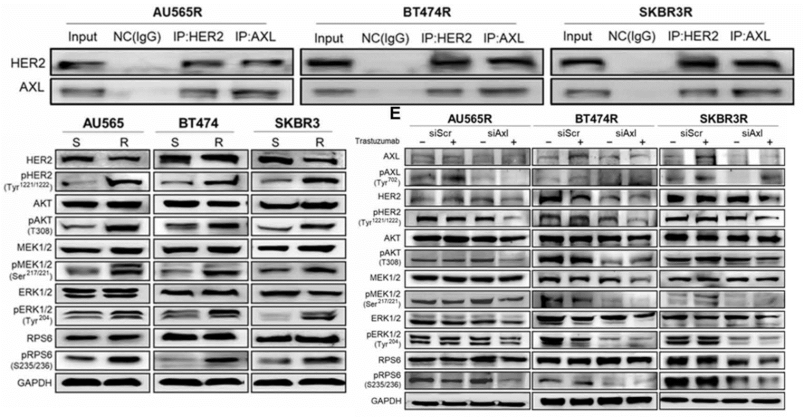
AXL与HER2形成异源二聚体并激活胞内PI3K/AKT/ERK/MAPK信号通路
以上的实验证据主要来自于细胞系实验,接下来研究团队希望在体内模型中验证上述结果。
通过将HER2+乳腺癌患者来源的肿瘤组织在小鼠体内或体外使用曲妥珠单抗长期处理,研究团队获得了对曲妥珠单抗治疗耐药的PDX模型。通过对PDX肿瘤进行检测,研究团队发现耐药的肿瘤细胞上调表达AXL以及EMT相关基因,但是没有检测到AXL的配体GAS6。这与细胞系实验结果一致。
那么联合曲妥珠单抗与AXL抑制剂能能否解肿瘤耐药难题呢?研究团队使用曲妥珠单抗联合AXL抑制剂治疗耐药PDX小鼠,发现联合治疗能够显著地抑制肿瘤生长,并使肿瘤在治疗21天后完全消退。
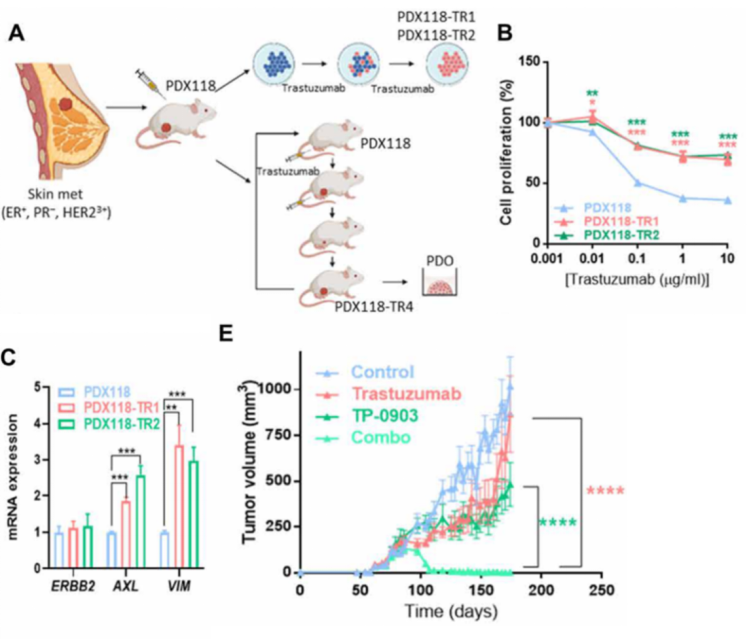
同时抑制HER2与AXL能够克服乳腺癌耐药,实现肿瘤消退
基于以上实验结果,研究团队推测AXL上调可能是HER2+乳腺癌患者对曲妥珠单抗治疗耐药的重要原因。为了验证这一假设,他们分析了HER2+乳腺癌患者肿瘤组织中AXL的表达。结果显示,相比于治疗后未复发的患者,抗HER2治疗后发生复发与转移的患者其原发瘤中AXL的表达显著上调,并且AXL的表达与患者的生存较差相关。这些数据表明,AXL可以作为HER2+乳腺癌患者预后标志物。
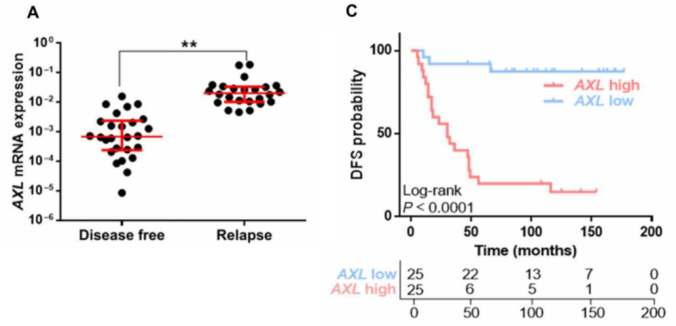
AXL的表达与乳腺癌患者不良预后相关
接下来研究团队检测了接受抗HER2治疗患者其肿瘤组织中AXL表达的变化情况,发现在接受治疗后14天AXL的表达就出现了明显上调,这种迅速的表达变化也提示AXL在乳腺癌获得耐药性的过程中扮演重要角色。
总的来说,这项研究成果表明AXL的高表达是HER2+乳腺癌获得耐药性的重要原因,并揭示AXL促进肿瘤耐药是通过诱导肿瘤细胞发生EMT,并激活胞内PI3K/AKT以及ERK/MAPK信号通路来实现的。

参考文献:
1. Moasser MM. The oncogene HER2: its signaling and transforming functions and its role in human cancer pathogenesis. Oncogene. 2007;26(45):6469-6487. doi:10.1038/sj.onc.1210477
2. Wang J, Xu B. Targeted therapeutic options and future perspectives for HER2-positive breast cancer. Signal Transduct Target Ther. 2019;4:34. Published 2019 Sep 13. doi:10.1038/s41392-019-0069-2
3. Mukohara T. Mechanisms of resistance to anti-human epidermal growth factor receptor 2 agents in breast cancer. Cancer Sci. 2011;102(1):1-8. doi:10.1111/j.1349-7006.2010.01711.x
4. Adam-Artigues A, Arenas EJ, Martínez-Sabadell A, et al. Targeting HER2-AXL heterodimerization to overcome resistance to HER2 blockade in breast cancer. Sci Adv. 2022;8(20):eabk2746. doi:10.1126/sciadv.abk2746
5. Liu L, Greger J, Shi H, et al. Novel mechanism of lapatinib resistance in HER2-positive breast tumor cells: activation of AXL. Cancer Res. 2009;69(17):6871-6878. doi:10.1158/0008-5472.CAN-08-4490
6. Elkabets M, Pazarentzos E, Juric D, et al. AXL mediates resistance to PI3Kα inhibition by activating the EGFR/PKC/mTOR axis in head and neck and esophageal squamous cell carcinomas. Cancer Cell. 2015;27(4):533-546. doi:10.1016/j.ccell.2015.03.010
7. Goyette MA, Duhamel S, Aubert L, et al. The Receptor Tyrosine Kinase AXL Is Required at Multiple Steps of the Metastatic Cascade during HER2-Positive Breast Cancer Progression. Cell Rep. 2018;23(5):1476-1490. doi:10.1016/j.celrep.2018.04.019
8. Davra V, Kumar S, Geng K, et al. Axl and Mertk Receptors Cooperate to Promote Breast Cancer Progression by Combined Oncogenic Signaling and Evasion of Host Antitumor Immunity. Cancer Res. 2021;81(3):698-712. doi:10.1158/0008-5472.CAN-20-2066
9. Leconet W, Chentouf M, du Manoir S, et al. Therapeutic Activity of Anti-AXL Antibody against Triple-Negative Breast Cancer Patient-Derived Xenografts and Metastasis. Clin Cancer Res. 2017;23(11):2806-2816. doi:10.1158/1078-0432.CCR-16-1316
10. Antony J, Tan TZ, Kelly Z, et al. The GAS6-AXL signaling network is a mesenchymal (Mes) molecular subtype-specific therapeutic target for ovarian cancer. Sci Signal. 2016;9(448):ra97. Published 2016 Oct 4. doi:10.1126/scisignal.aaf8175
11. Scaltriti M, Elkabets M, Baselga J. Molecular Pathways: AXL, a Membrane Receptor Mediator of Resistance to Therapy. Clin Cancer Res. 2016;22(6):1313-1317. doi:10.1158/1078-0432.CCR-15-1458
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


