《科学·转化医学》:以”癌“之矛!华科团队提出用肿瘤来源微粒搭载琥珀酸,让肿瘤微环境内巨噬细胞“改邪归正”的高招
来源:网络 2025-04-12 16:17
华中科技大学同济医学院唐科、黄波等国内研究者在《科学·转化医学》期刊发表的最新论文[1],就提出了以代谢重编程调控肿瘤相关巨噬细胞(TAMs)极化,使它们从促癌转换回抑癌角色的方案:用肿
华中科技大学同济医学院唐科、黄波等国内研究者在《科学·转化医学》期刊发表的最新论文[1],就提出了以代谢重编程调控肿瘤相关巨噬细胞(TAMs)极化,使它们从促癌转换回抑癌角色的方案:用肿瘤来源微粒(tumor-derived microparticles)向TAMs精准“投喂”琥珀酸。
研究显示,搭载琥珀酸的肿瘤来源微粒(SMPs)可被精准递送到TAMs的线粒体和细胞核内,引发IDH2及组蛋白H3K122的琥珀酰化修饰,前者可使IDH2在三羧酸循环(TCA)中的活性被抑制,后者则富集在乳酸脱氢酶A(LDHA)编码基因的启动子区域以增强其表达,TAMs的糖酵解能力就会经由这两种调控途径显著增强,使其向抑癌的M1表型极化。
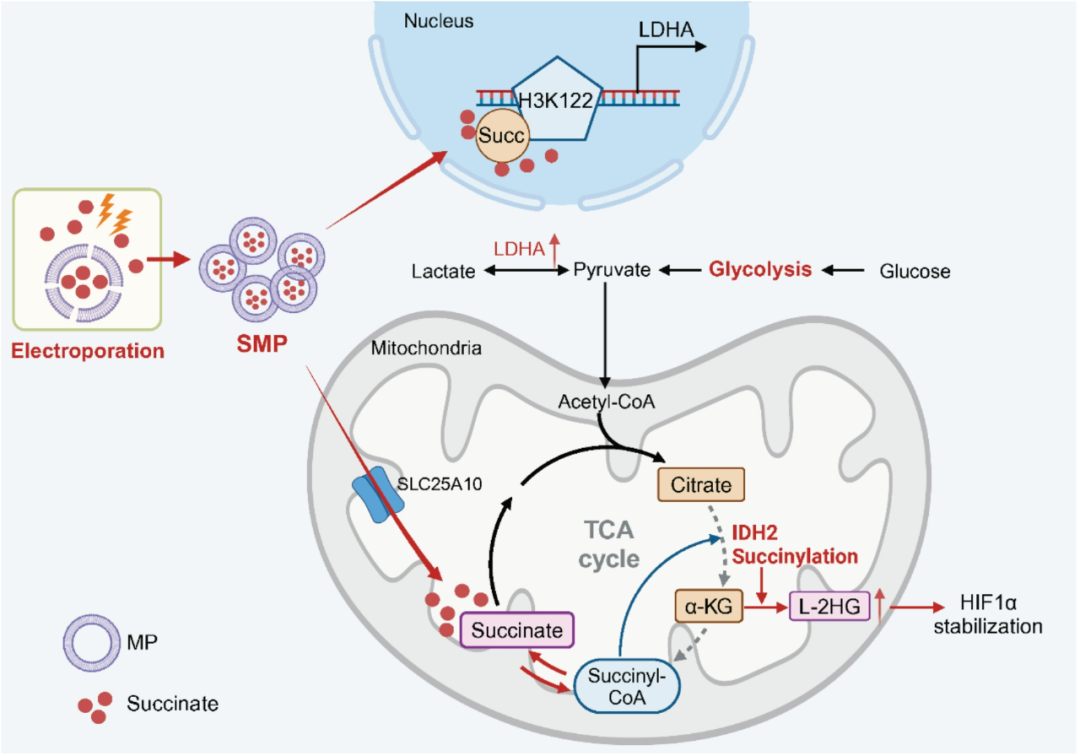
一图总结论文核心发现
用肿瘤来源微粒实现精准投递,正是开展本次研究的黄波团队长期深耕的领域,这种微粒的好处就是容易被巨噬细胞一口吞下,如果是癌细胞产生的“原装”微粒,巨噬细胞吞完往往就会当场化身促癌帮凶[2],所以这一招颇有点“以子之矛攻子之盾”的意思。不过,癌细胞也能直接分泌琥珀酸使巨噬细胞向M2型极化[3],和前天提到的投喂精氨酸十分相似。
因此用肿瘤来源微粒搭载琥珀酸,还有另一层同样关键用意,即让琥珀酸经胞吞途径被摄取,直接递送到TAMs内部进入糖酵解代谢途径中,而不是放任TAMs从细胞外摄取癌细胞的投喂,激活细胞膜表面其它受体,使TAMs向M2表型极化。基于这些考量,研究者们首先利用电穿孔技术,将琥珀酸稳定且高效地封装到肿瘤来源微粒内,也就是制备了奇点糕开头提到的SMPs,再逐步验证SMPs对TAMs极化的调控作用以及对肿瘤的影响。
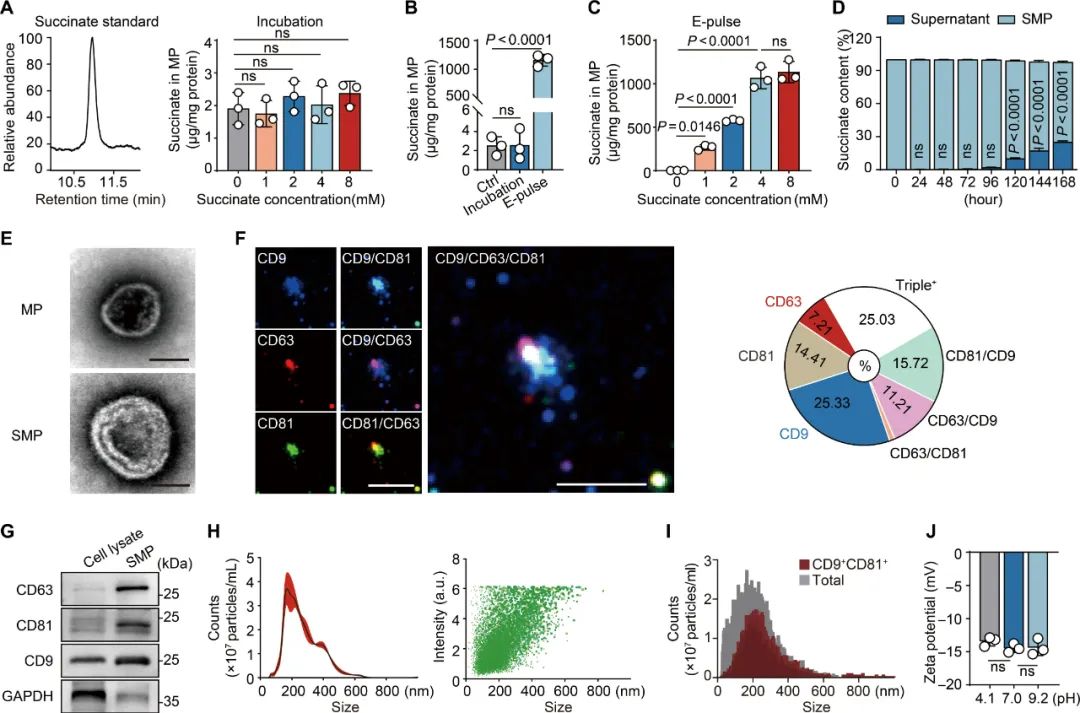
制备SMPs流程的简要介绍及关键指标验证流程
体外实验首先证实,SMPs可被骨髓来源巨噬细胞(BMDMs)高效吞噬,并如预期一样避开TAMs从细胞外摄取琥珀酸并激活的通路(SUCNR1受体),通过“胞内机制”诱导Nos2上调、Arg1下调,使巨噬细胞向M1样表型极化,诱导促炎性细胞因子表达、下调免疫抑制性细胞因子表达;即使已经向M2表型极化的TAMs,也会被SMPs给“拉回来”。
SMPs调控TAMs极化的作用,就会在肿瘤小鼠模型上转化为明确的抑癌作用,且肿瘤微环境中的CD8+T细胞、中性粒细胞和树突状细胞都会受其影响,表现出更强的抗癌战斗力,而游离琥珀酸或其它载体搭载的琥珀酸都不能带来类似改变。值得一提的是,SMPs起效并不需要其来源癌细胞的MHC分子与巨噬细胞匹配,所以它的使用是具有普适性的。
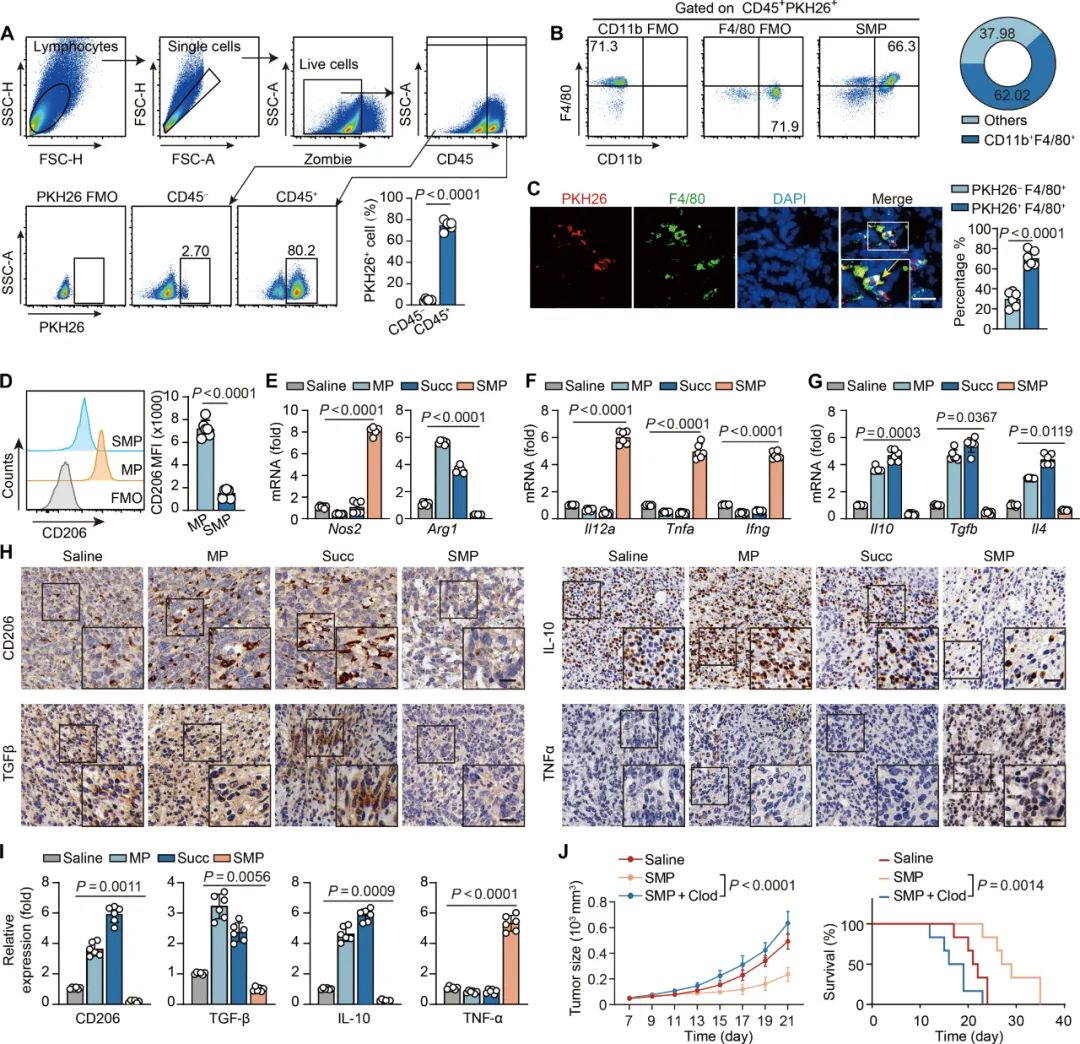
SMPs通过调控TAMs极化,起到明确的抑癌作用
而SMPs调控TAMs极化的机制,正是从代谢重编程开始:代谢组学分析显示,SMPs处理后水平发生显著改变的代谢物,主要集中在糖酵解和TCA循环通路,反映的现象简单总结,就是糖酵解增强、TCA循环减弱;进一步分析显示,TAMs内的多种糖酵解关键酶表达均有明显上调,但TCA循环中的IDH2等关键酶表达却没有明显下降,这该怎么解释呢?
答案就是奇点糕此前也提过的“琥珀酰化修饰”了,但具体机制要分两头来说:在SMPs处理后大量进入TAMs线粒体内的琥珀酸,会诱导线粒体内的IDH2发生琥珀酰化,使IDH2的酶活性下降,不再正常参与TCA循环,而是将中间代谢产物转化为L-2羟基戊二酸(L-2HG),L-2HG则会增强TAMs内HIF-1α的稳定性,上调巨噬细胞炎症信号[4]。
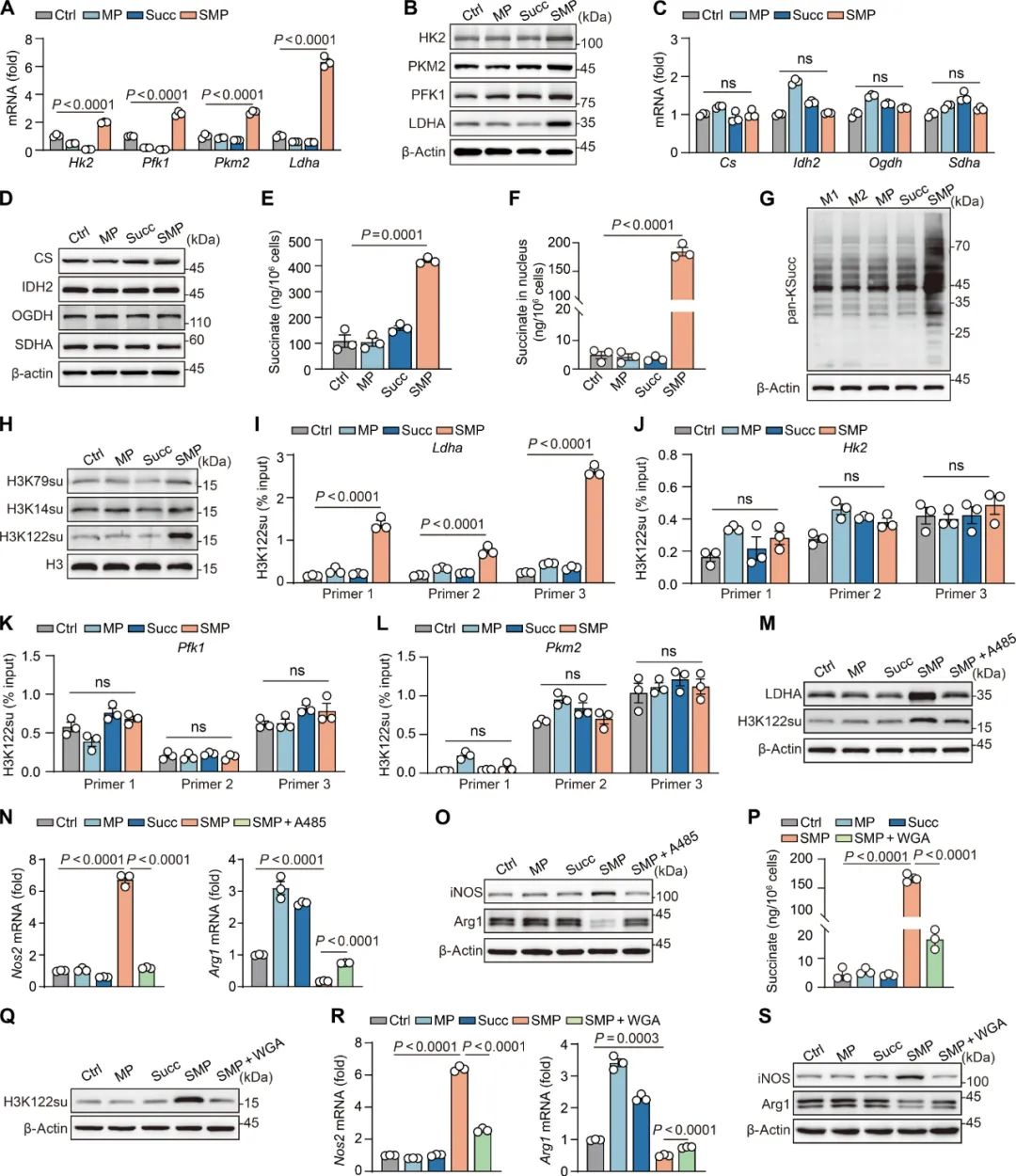
SMPs处理可使线粒体内的IDH2被琥珀酰化修饰,抑制TCA循环
而另外一边,进入细胞核内的琥珀酸会特异性修饰组蛋白H3K122位点,且主要影响对象是Ldha的启动子区域,以此上调LDHA表达水平,让它去主导TAMs糖酵解能力的增强,进而使TAMs向M1表型极化,SMPs也就圆满完成了自己的使命,而且研究者们还指出,SMPs的制备过程相当简洁且很有性价比,所以向临床应用转化应该也不是什么难事。
参考文献:
[1]Lu S, Li J, Li Y, et al. Succinate-loaded tumor cell–derived microparticles reprogram tumor-associated macrophage metabolism[J]. Science Translational Medicine, 17(793): eadr4458.
[2]Zhang H, Yu Y, Zhou L, et al. Circulating tumor microparticles promote lung metastasis by reprogramming inflammatory and mechanical niches via a macrophage-dependent pathway[J]. Cancer Immunology Research, 2018, 6(9): 1046-1056.
[3]Wu J Y, Huang T W, Hsieh Y T, et al. Cancer-derived succinate promotes macrophage polarization and cancer metastasis via succinate receptor[J]. Molecular cell, 2020, 77(2): 213-227. e5.
[4]Tannahill G M, Curtis A M, Adamik J, et al. Succinate is an inflammatory signal that induces IL-1β through HIF-1α[J]. Nature, 2013, 496(7444): 238-242.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


