诺奖团队用CRISPR“粉碎癌症”,靶向非编码序列,清除脑肿瘤
来源:生物世界 2023-12-04 16:43
这种基于CRISPR的癌症粉碎提出了一种创新的治疗范式,它独立于肿瘤的遗传和表观遗传起源,将超突变癌症的肿瘤突变负荷和化疗药物TMZ信号转化为一种潜在治疗途径。
近日,格拉斯通研究所、加州大学伯克利分校等机构的研究人员合作,在 Cell 子刊 Cell Reports 上发表了题为:Targeting the non-coding genome and temozolomide signature enables CRISPR-mediated glioma oncolysis 的研究论文。
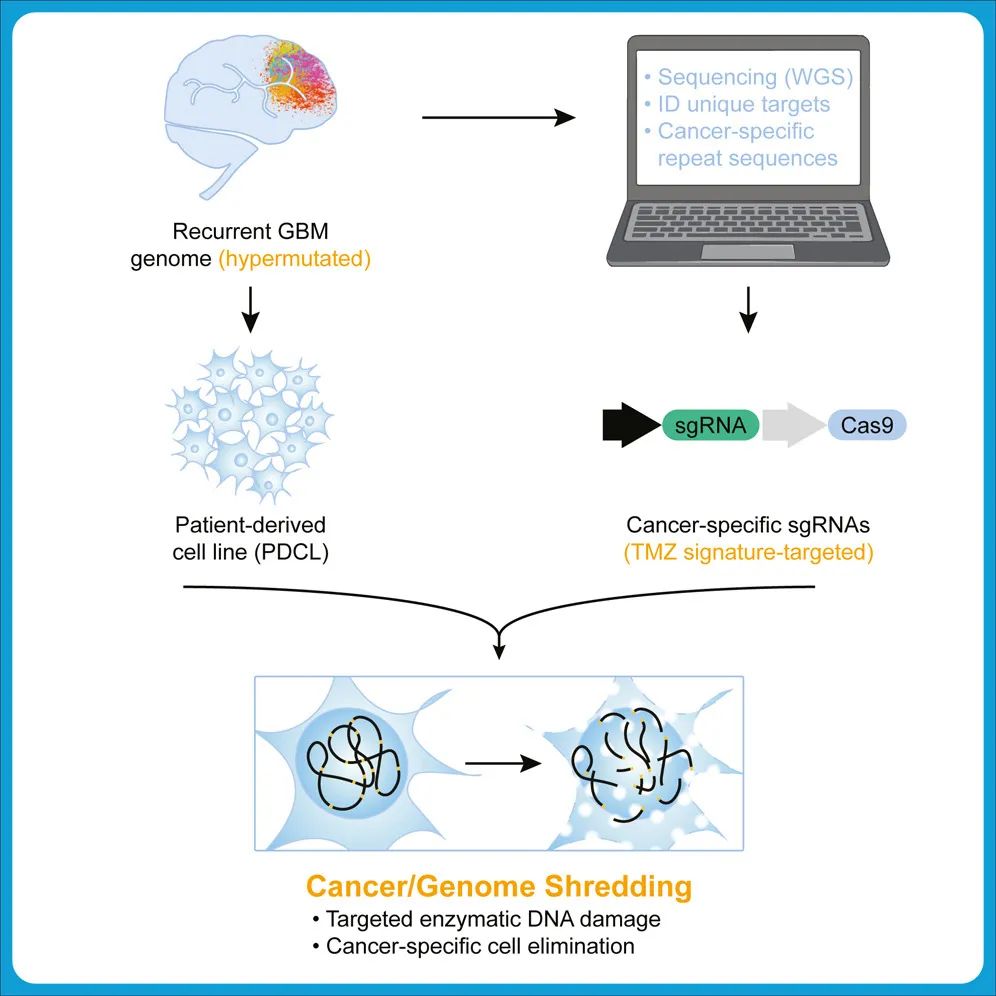
该研究开发了一种基于CRISPR的“癌症粉碎”方法,靶向切碎癌细胞特异性的非编码的重复序列,从而清除癌细胞,用于治疗胶质母细胞瘤。

源自细菌和古菌适应性免疫系统的CRISPR系统,能够在基因组的目标位点上引入RNA引导的DNA双链断裂(DSB),从而在人类细胞中进行可编程的基因编辑。而CRISPR疗法的一个潜在风险也正是由于其产生的DNA双链断裂可能导致细胞毒性效应。
此前,George Church、杨璐菡等人为了构建可用于人类器官移植的基因编辑猪,使用CRISPR-Cas9基因编辑技术在猪细胞系和活猪体内原代细胞中分别实现了62处和25处基因编辑。但我们目前尚不清楚多少个这样的DNA双链断裂能够消除一个细胞,以及这是否可以被利用来作为一种有效的抗癌方式。
在这项最新研究中,针对中枢神经系统(CNS)癌症,研究团队提出通过靶向肿瘤基因组中独特的重复序列,利用CRISPR-Cas9基因编辑时产生的DNA双链断裂带来的细胞毒性效应,作为治疗复发性超突变胶质瘤的新策略,研究团队将这一概念称为——CRISPR“癌症粉碎”。
具体来说,研究团队发现了DNA损伤反应(DDR)基因的生殖细胞缺陷可能导致了原发性GBM肿瘤的高突变负荷,以及对GBM细胞永生化至关重要的TERT启动子的体细胞突变。此外,复发性GBM在遗传上与原发性GBM不同,前者具有与恶性肿瘤进展和超突变有关的额外突变。
该研究还发现,GBM的一线化疗药物替莫唑胺(TMZ)治疗所诱导的复发性GBM超突变,可以导致独特的、癌症特异性的非编码的重复序列。重要的是,这些非编码重复序列可以被CRISPR-Cas9所靶向切割,在这些位点切割癌细胞基因组,使其基因组碎片化,导致DNA损伤又到的细胞死亡,从而选择性清除患者来源的复发性GBM细胞系,同时保留了正常细胞。
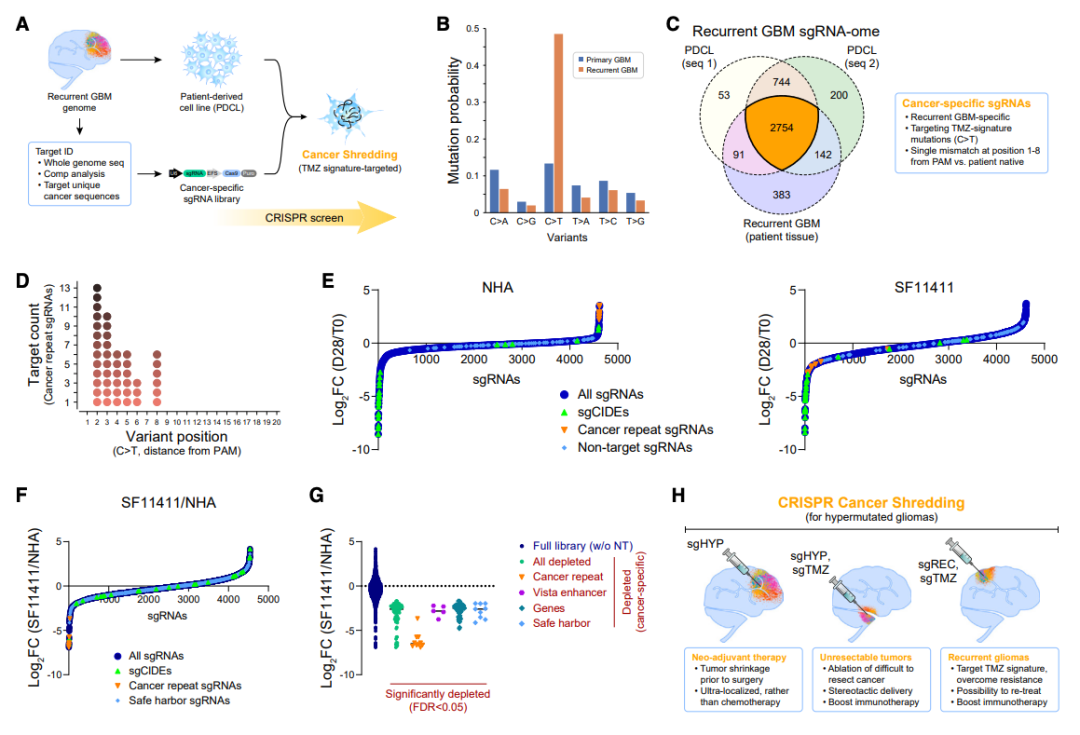
这种基于CRISPR的癌症粉碎提出了一种创新的治疗范式,它独立于肿瘤的遗传和表观遗传起源,将超突变癌症的肿瘤突变负荷和化疗药物TMZ信号转化为一种潜在治疗途径。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


