第四军医大学研究者们揭示了胃癌潜在的生物标志物和治疗靶点
来源:生物谷原创 2023-08-29 15:29
肿瘤的发生、发展和转移在宿主组织中引起广泛的动态变化,导致形成复杂的肿瘤间质,也称为肿瘤微环境(TME)。显然,细胞骨架重塑相关基因的激活和失活失去平衡是肿瘤转移的关键步骤。
肿瘤的发生、发展和转移在宿主组织中引起广泛的动态变化,导致形成复杂的肿瘤间质,也称为肿瘤微环境(TME)。显然,细胞骨架重塑相关基因的激活和失活失去平衡是肿瘤转移的关键步骤。然而,癌症的进展和转移并不完全依赖于癌细胞自主缺陷,来自TME的刺激触发或增强了这一过程,创造了一个局部微环境,使癌细胞能够获得过度的运动性,迁移到远处并形成转移的壁龛。

图片来源:https://doi.org/10.1038/s41419-023-05965-z
近日,来自第四军医大学的研究者们在Cell Death and Disease杂志上发表了题为“Cancer associated fibroblast derived SLIT2 drives gastric cancer cell metastasis by activating NEK9”的文章,该研究揭示了肿瘤相关成纤维细胞来源的SLIT2通过激活NEK9促进胃癌细胞转移。
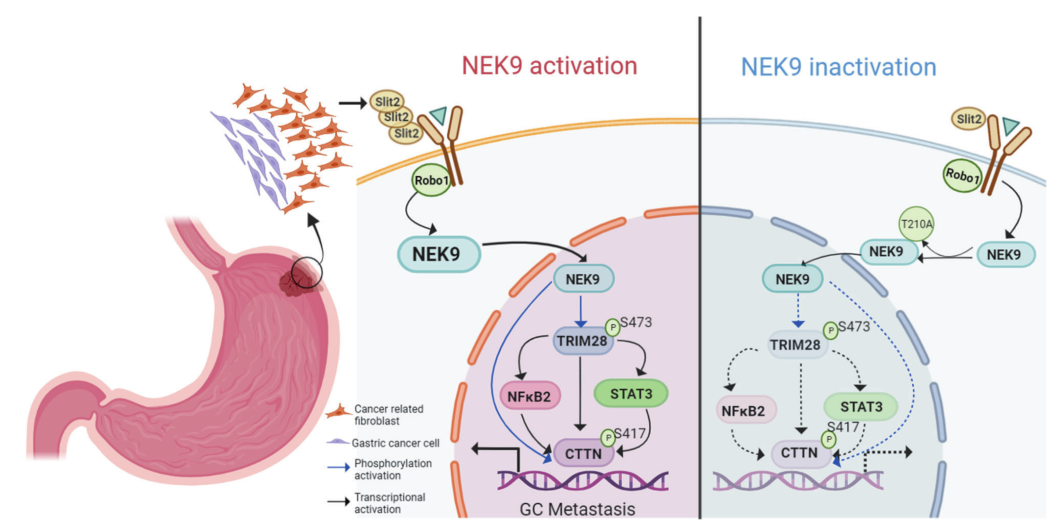
肿瘤相关成纤维细胞(CAF)的分泌特性在形成有利于转移的肿瘤微环境中起着主要作用。本研究证实了由CAF产生的轴突引导蛋白Slit2通过与迂回引导受体1(Robo1)结合而促进两种胃癌细胞系(AGS和MKN45)的转移。
质谱分析表明,Robo1可以与丝氨酸/苏氨酸激酶NEK9相互作用。Slit2进一步增强了它们的相互结合活性。结构域分析表明,在AGS和MKN45细胞中,NEK9的激酶结构域在其与Robo1的胞内区(ICD)的相互作用中是关键的,它还直接磷酸化了含有28(TRIM28)和皮质蛋白(CTTN)的三聚体基序。
TRIM28是一种转录延伸因子,直接促进CTTN的激活。此外,生物信息学分析和实验验证证实了STAT3和NF-κB p1 0在转录水平上受T R I M 2 8的调控,在AGS和MKN 4 5中也观察到了STAT3和NF-κB p10 0对CTTN的转录调控。因此,CaF来源的Slit2上调CTTN的表达和磷酸化水平,从而诱导细胞骨架重组和GC细胞转移。
转移性胃癌组织中NEK9、TRIM28和CTTN的表达水平同时高于配对的非癌组织和原发癌组织。对一组GC患者的数据分析表明,NEK9、TRIM28和CTTN水平的增加与总体存活率的下降有关。
Slit2/Robo1/NEK9信号通路在胃癌中的模型
图片来源:https://doi.org/10.1038/s41419-023-05965-z
综上所述,本研究发现,CAF来源的Slit2通过增强Robo1和NEK9之间的相互作用而促进胃癌转移。NEK9通过靶向TRIM28和CTTn的磷酸化而发挥激酶的作用,并触发IL-6/STAT3和NF-κB通路的激活。NEK9连接了CAF和炎症信号通路的刺激,形成了一种独特的TME,用于细胞骨架重组和癌症转移。这些发现可能有助于更好地理解TME在胃癌转移中的作用。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


