《自然·医学》:bTMB里程碑!**bTMB指导免疫治疗的前瞻临床研究最终分析结果公布
来源:奇点糕 2022-05-10 11:57
肺癌是威胁人类健康的第一大癌症,让无数人为之心焦,好在近年来在靶向治疗的基础上,免疫治疗的兴起,为缓解这一疾病负担带来了希望。
肺癌是威胁人类健康的第一大癌症,让无数人为之心焦,好在近年来在靶向治疗的基础上,免疫治疗的兴起,为缓解这一疾病负担带来了希望。
然而,并不是每个人都能从免疫治疗中获益,PD-L1表达能帮我们缩小范围,TMB(肿瘤突变负荷)也有一定价值,但它们都依赖肿瘤组织的检测,而晚期肺癌有30%的患者压根就取不到足够的组织[1],因此探索并验证基于血液的预测标志物就显得尤为重要。
其中,距离临床应用最近的就数bTMB(blood TMB),它是对血浆中游离DNA片段进行测序分析,计算得到的肿瘤突变负荷。既往多项回顾性研究已经证实了bTMB对PD-1/PD-L1抑制剂疗效预测的有效性[2-3]。但目前尚缺少前瞻性研究证据。
近日,由希望之城国家医疗中心的Edward S Kim教授和克利夫兰诊所的Vamsidhar Velcheti教授领衔的研究团队,在著名期刊《自然·医学》发表重要研究成果,公布了首个bTMB前瞻性临床研究的最终分析结果。
他们发现在接受一线阿替利珠单抗(PD-L1抑制剂)的非小细胞肺癌患者中,bTMB越高,越倾向于获得更高的客观缓解率(ORR),更长的总生存期(OS)和无进展生存期(PFS)。尽管基于预设的bTMB阈值分组(≥16 vs<16),PFS无显著差异,高bTMB患者长程随访后的OS获益显著。
这一研究前瞻性地论证了bTMB对免疫治疗疗效的预测价值,同时也提出了bTMB未来的优化方向,为bTMB进入临床实践,向标准化检测进军,奠定了重要的基础。

论文首页
在正式介绍这个研究之前,我们有必要先了解一下背景。早在2018年本文中bTMB检测技术的开发者,Foundation Medicine公司,就与临床专家合作,也是在《自然·医学》上发表了bTMB回顾性研究数据[2]。
在该研究中,他们开发了一套在血液中检测TMB的技术方案,然后在两个肺癌免疫治疗队列:POPLAR(NCT01903993)和OAK(NCT02008227)中进行测试和验证。
先是比较了bTMB与组织TMB的关系,发现两者高度相关。接着在POPLAR队列中摸索不同bTMB阈值与疗效的关系,确定了bTMB≥16(Panel大小1.1M,相当于14.5 mut/Mb)为最佳阈值。最后用此阈值在OAK队列中进行验证。结果显示,bTMB≥16人群接受免疫治疗,PFS显著优于化疗;而bTMB<16人群两种治疗方式无显著差异。
该研究首次证实了bTMB对于免疫治疗疗效的预测价值,在当时的学术界和产业界引起了不小的轰动。而本研究正是以此回顾性研究为基础,开展的前瞻性临床试验。
这是一项II期临床试验,代号为B-F1RST(NCT02848651),于2016年9月启动,至2019年7月截止,随访至2020年12月。自2018年开始,在ASCO、ESMO等国际肿瘤大会上频频亮相,备受关注,本次公布了其随访3年后的最终分析结果。
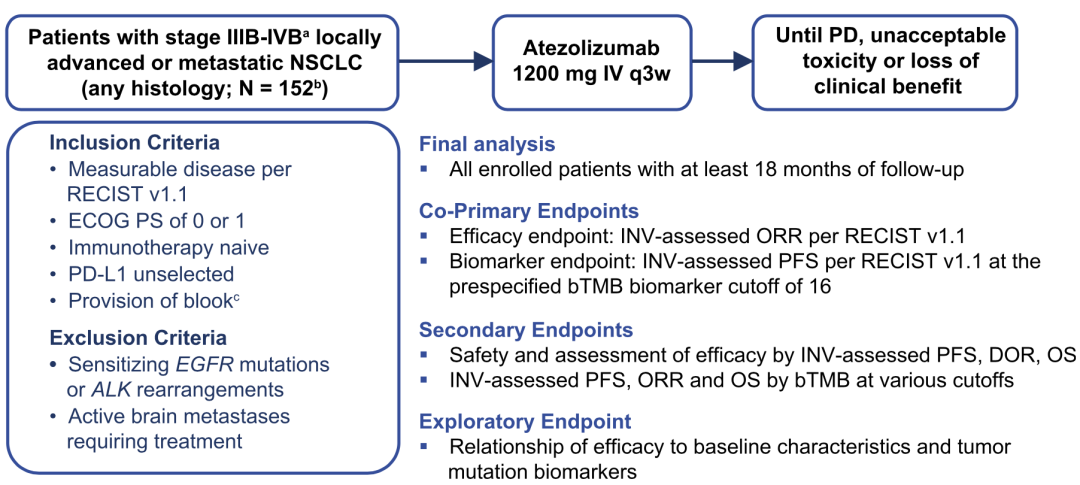
B-F1RST研究的设计
研究纳入了接受一线阿替利珠单抗治疗的IIIB-IVB期非小细胞肺癌患者152例,排除了EGFR/ALK驱动变异,不限制PD-L1的表达,不限制病理类型。主要终点是客观缓解率,以及bTMB≥16与PFS的关系。次要终点是安全性、其他疗效指标、以及不同bTMB阈值与疗效的关系。
值得注意的是,当外周血ctDNA(肿瘤来源的游离DNA)含量很低时,低频突变的丰度可能会低于最低检测限,而导致bTMB结果不准确。因而在本研究中,研究者定义当MSAF≥1%时(突变丰度最高的那个变异≥1%),ctDNA的含量较为充足,此时bTMB的结果是可靠的。
在本研究中共有119例患者(占比78%)MSAF≥1%,进行了后续的bTMB分析,其中bTMB≥16有28人(占比24%),bTMB<16有91人(占比76%)。
我们来看结果,首先,bTMB≥16是不是能有更长的PFS。很可惜,bTMB≥16对比bTMB<16组,中位PFS为5 vs 3.5个月,HR值0.8,P值0.35。数字上有提升,但统计学没有差异。
研究者分析这可能与样本量不足有关。按照119例的样本量,要做出统计差异,需要bTMB高低两组PFS的HR值达到0.55,也就是说高bTMB患者的无进展风险要降低45%,这个难度还是很大的。
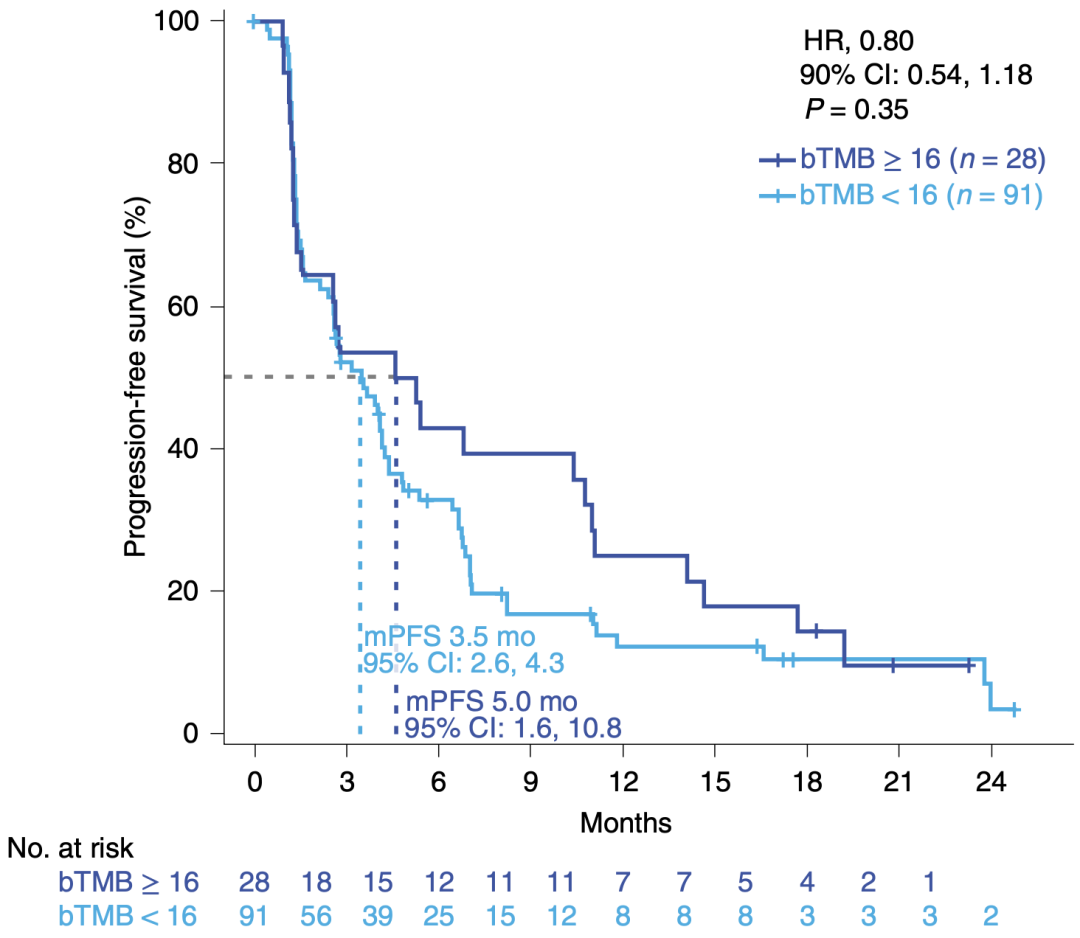
bTMB≥16 vs bTMB<16,两组PFS的差异
尽管PFS不够显著,接下来的分析还是给了我们信心。研究者发现,同样以bTMB≥16为阈值,高低两组的ORR为:35.7% vs 5.5%,P<0.0001,差异相当显著。并且随着bTMB的阈值提高,ORR的差异会更进一步增加。
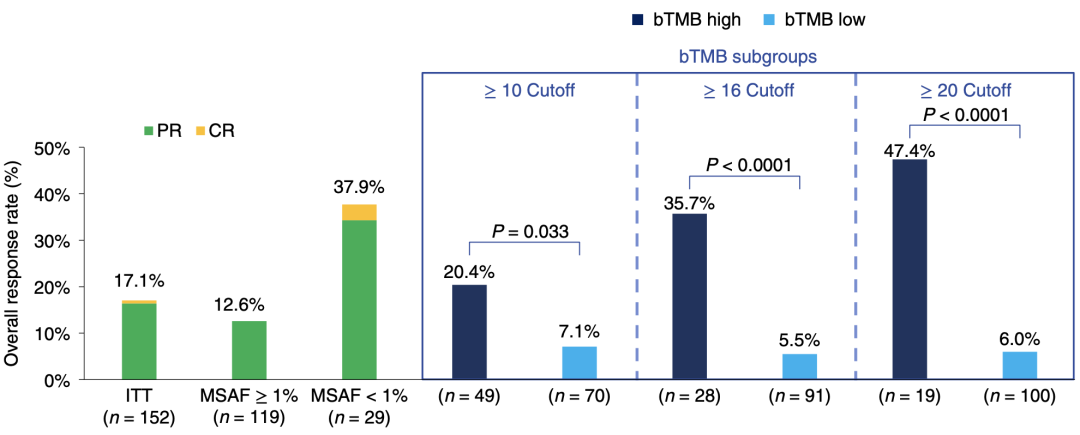
ITT人群、不同MSAF人群、不同bTMB阈值人群的ORR
在疗效瀑布图中,我们可以看到bTMB高的患者基本都集中在右边,有着不同程度的肿瘤缓解。同时,我们也可以看到PD-L1的高表达与bTMB高并不一致,统计学分析也确实发现两者之间没有显著相关性,这提示bTMB可能是独立于PD-L1表达的能预测疗效的指标。
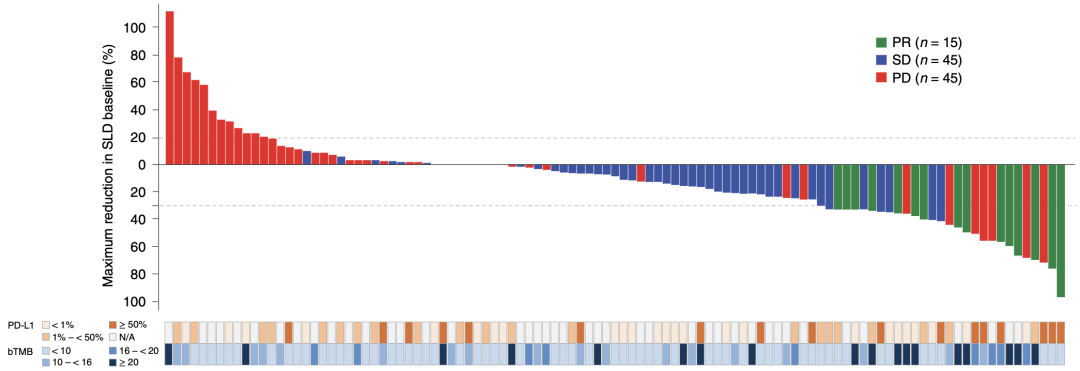
不同PD-L1分组、bTMB分组肿瘤的缓解程度
在后续的分析中,研究者还发现,从低往高不断调整bTMB的阈值,无论是PFS还是OS,高bTMB与低bTMB组的差异都是越来越显著。
当bTMB阈值定为20时,两组PFS为:6.9 vs 2.9个月,HR值0.59,P值0.056,已经很接近有统计学意义了。
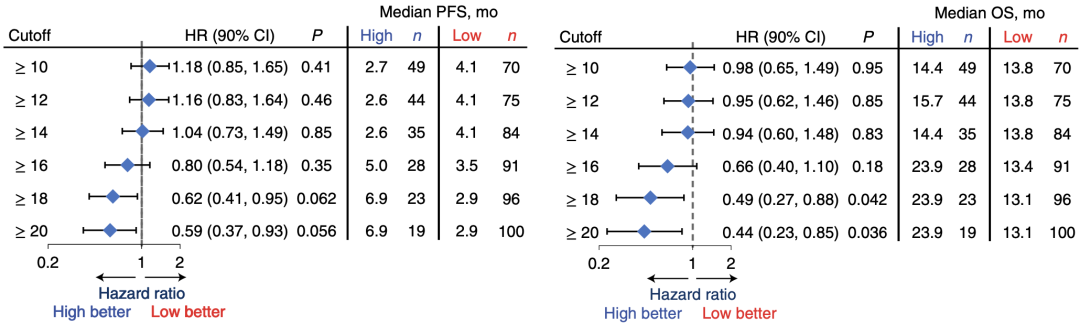
不同bTMB阈值,高低bTMB两组PFS、OS的差异
但阈值越高,也会导致高bTMB的患者比例很少,从而漏掉很多能从免疫治疗中获益的人。
我们知道免疫治疗一旦有效,获益会很持久,所以OS上会有优势。在随访达3年后,仍以bTMB≥16为阈值,高低两组OS为:29.1 vs 13.4个月,HR值0.54,P值0.032。数字上差异巨大,统计学也达到了显著。
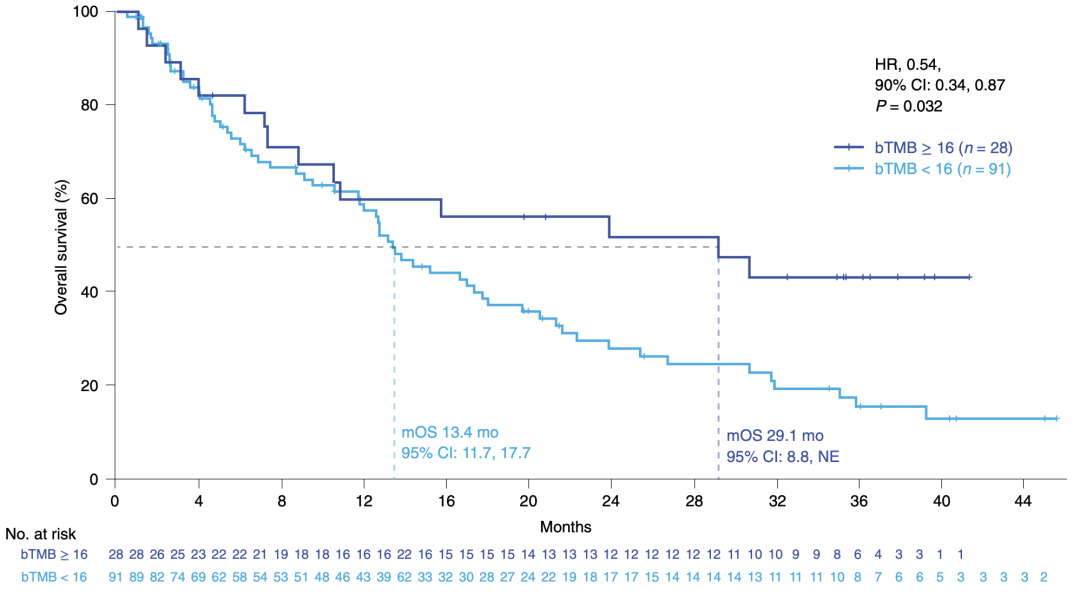
以bTMB≥16为阈值,长程随访后,bTMB高低两组OS的差异
这也进一步印证了bTMB作为免疫疗效预测指标的价值,它能够找到真正长期获益的患者。
大家应该还记得,在这个研究中,还有部分患者无法评估bTMB,共33人(占比22%)。因为他们的MSAF<1%,ctDNA的含量很低。这个MSAF有什么临床意义呢。
MSAF(maximum somatic allele frequency)意思是:最大体细胞等位基因丰度,就是能测到的最大突变丰度。用这个最大丰度可以粗略推算ctDNA占总体游离DNA的比例,从而反映出ctDNA的含量。
ctDNA是由肿瘤细胞坏死、凋亡而来,半衰期很短,它可以实时反映肿瘤负荷的高低。因此我们可以猜想,MSAF越低,肿瘤负荷应该也越低,预后也越好。结果也确实如此,MSAF<1%的患者各项临床病理特征都是更好的,并且PFS也显著高于MSAF≥1%组。
也正是因为MSAF反映了肿瘤的负荷,当应用倾向性评分方法平衡了MSAF≥1%与<1%患者的临床病理特征之后,两组间的PFS的差异就不再显著了。
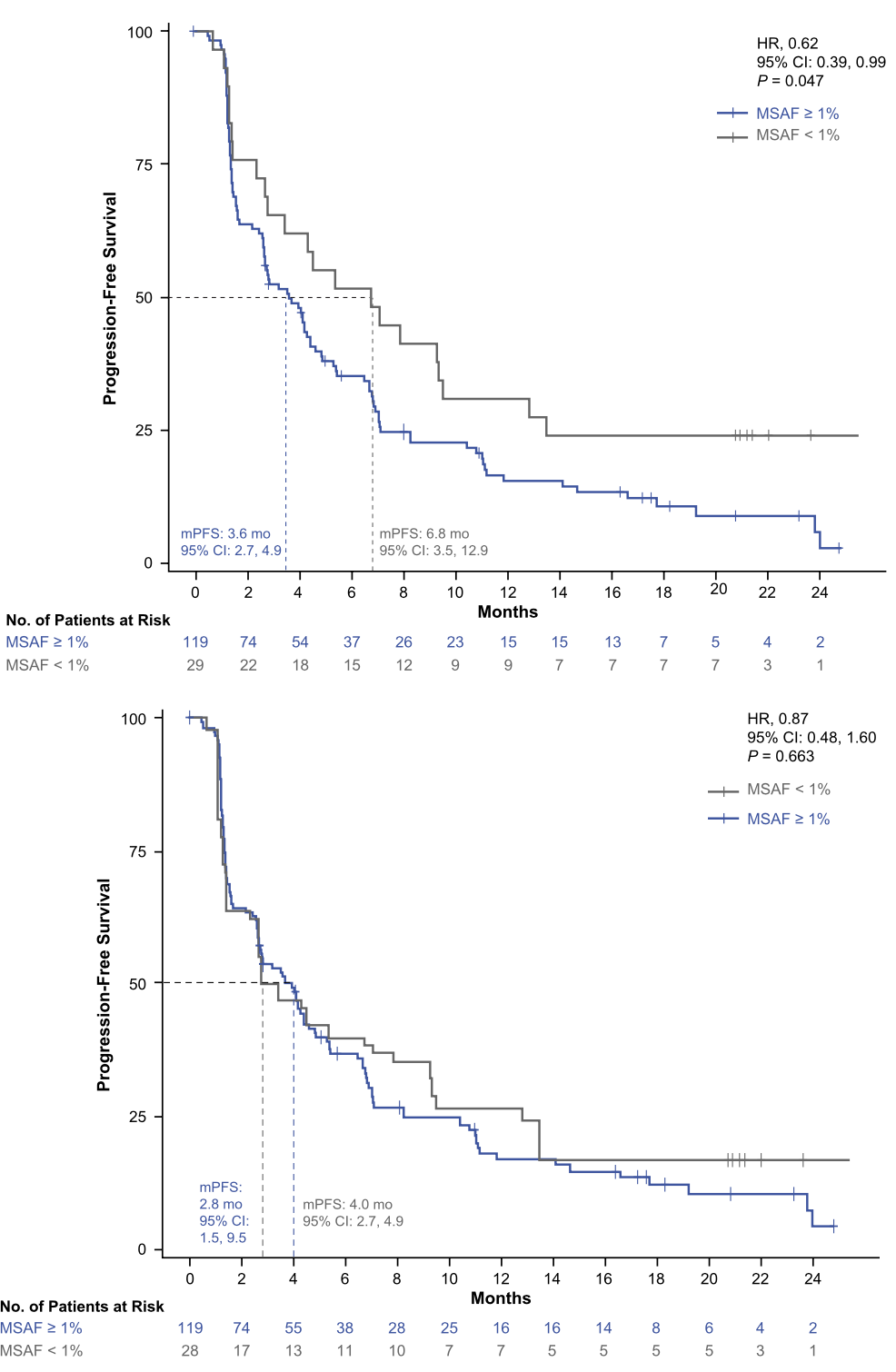
MSAF≥1% vs MSAF<1%,校正前与校正后的PFS差异
所以,如果患者的MSAF过低,不能计算bTMB,也许还是一件好事,这些患者预后会更好,但是否能使用免疫治疗,可能还需要别的标志物的帮助。
最后,本研究对所有完成检测的患者的基因组特征进行了分析,探索其与bTMB关系。完成检测的患者,定义为MEP(Molecularly Evaluable Population),共148人。
研究人员发现,相较于bTMB<16组的患者,bTMB≥16组的患者富集了更多的TP53、LRP1B和CDKN2A变异,其中TP53在两组间有显著差异。
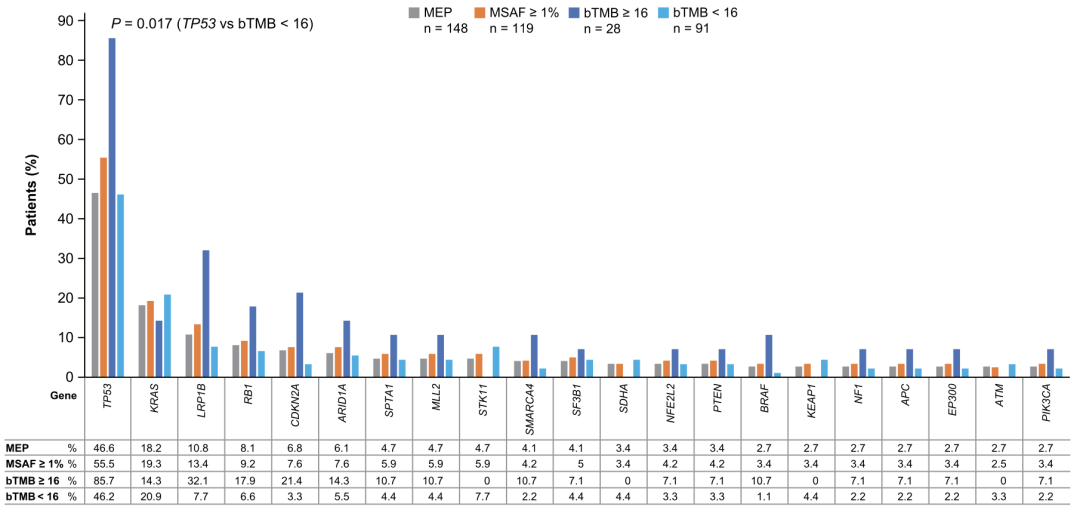
MEP组、MSAF组、bTMB≥16、bTMB<16组基因组特征的比较
综合以上结果,我们可以认为,B-F1RST研究很好的论证了bTMB在一线免疫治疗疗效预测中的价值,尽管因为样本量有限,PFS并没有显著差异,但ORR和OS的结果还是给了我们对于bTMB这一标志物的信心。
特别是对于PD-L1阴性或没有足够组织样本进行PD-L1检测的患者,bTMB能让我们在选择免疫治疗时,多一盏灯,增加患者获益的可能。
然而,bTMB作为预测免疫疗效的标志物,也存在着一些问题,这些问题的根本还是在于TMB本身。
我们知道,TMB之所以能预测疗效,是因为它可以反映新抗原负荷,新抗原越多越能激活免疫,从而免疫疗效更好。也就是说,bTMB也好,组织TMB也好,它们都是新抗原负荷的替代指标。
熟悉免疫循环的朋友们,肯定还记得,免疫效应发挥的七大步骤。新抗原的释放、呈递、再到T细胞的激活、迁移、浸润、识别,最后发挥杀伤功能,是很长很复杂的过程。新抗原只是其中一环,离最终发挥效应很远[4],中间的其他影响因素还有很多,因此要准确预测疗效非常困难。
这告诉我们,bTMB还有很多优化空间,包括去考虑纳入计算的突变的免疫原性,考虑免疫循环中其他因素对TMB的影响,还包括如何选择一个合适的阈值等。
另外,正因为免疫效应发挥的路径很长,涉及因素很多,在选择免疫治疗时,bTMB需要和包括PD-L1在内的其他标志物,进行组合,综合考虑。
尽管目前bTMB还没有获批为免疫治疗伴随诊断或补充诊断的标志物,但因其在组织不可获取时独特的价值,无论是国外还是国内,都已经被作为临床上可参考的一个指标。
B-F1RST研究是bTMB走入临床实践的一个里程碑,同时还有很多bTMB相关的研究正在开展之中,相信bTMB的价值会被进一步的挖掘,性能也会进一步提高。
希望不久的将来,bTMB能够更加规范化、标准化的应用于临床实践,从而能够惠及更多患者,为他们带来更多获益。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


