Cell Metab | 婴幼儿代谢生长和遗传疾病的预测模型
来源:生物探索 2024-07-12 12:50
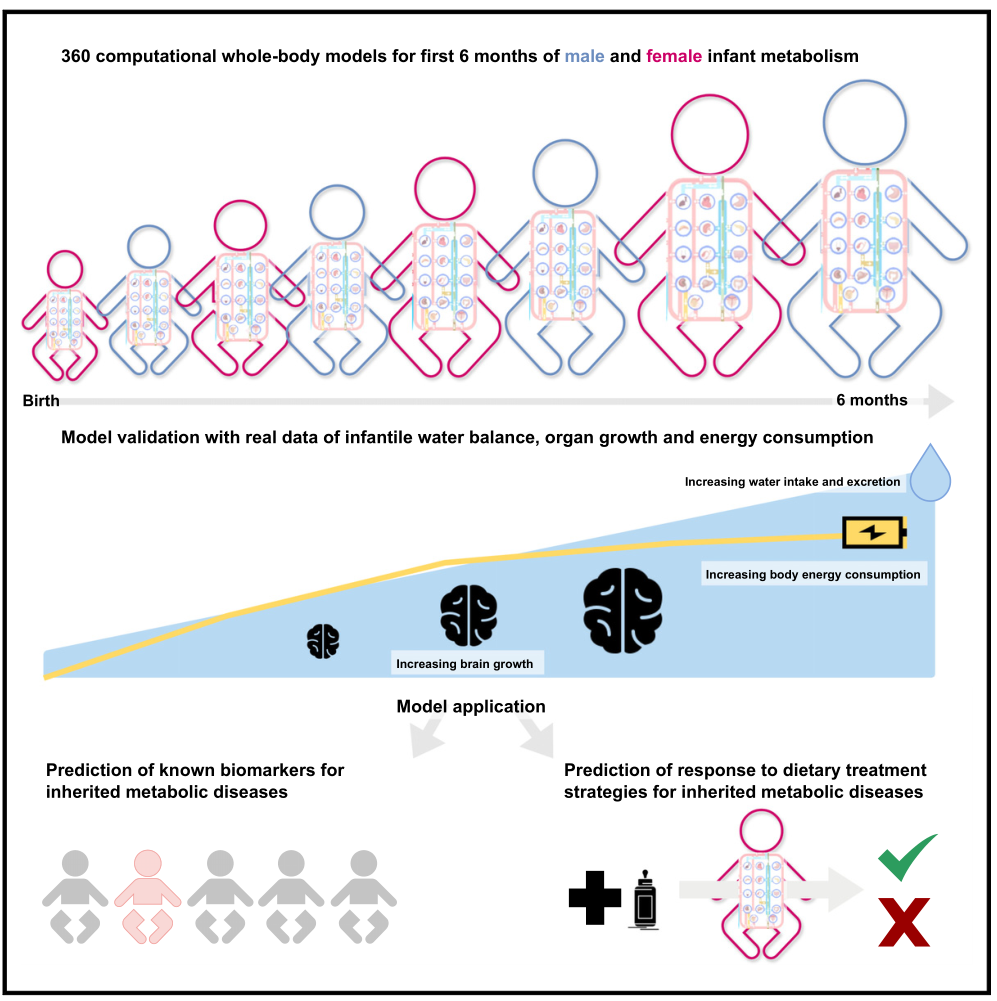
该研究介绍了婴儿-WBMs,这是一种考虑性别特异性和器官差异的婴儿代谢模型资源,可预测婴儿出生后0至6个月的生长情况,并能准确预测IMDs中血液生物标志物的变化,为新生儿和婴儿代谢研究提供了重要资源。
新陈代谢对婴儿期的发育至关重要【1】。数学模型为了解婴儿代谢提供了系统方法,可用于预测疾病发展和评估药物代谢。这些模型整合了生理数据,能够模拟复杂的代谢过程,如婴儿生长过程中营养素的平衡和皮肤的渗透性。另外,基于生理的药代动力学模型能够评估婴儿的药物代谢【2】,为个性化医学提供了潜在的机会。
近日,来自爱尔兰高威大学医学院的Ines Thiele团队在Cell Metabolism期刊发表题为Personalized metabolic whole-body models for newborns and infants predict growth and biomarkers of inherited metabolic diseases(个性化代谢全身模型用于预测婴幼儿生长和遗传代谢疾病生物标志物)的文章。研究人员成利用器官特异性的全身模型(whole-body models,WBMs),结合婴儿的代谢特征和数据,成功预测了婴儿的生长、生物标志物的变化以及在遗传代谢疾病(inherited metabolic diseases,IMDs)治疗中的效果。这项研究为个性化医学提供了希望,为数字个性化医疗在新生儿和婴儿代谢领域的应用奠定了基础。

基因组规模代谢模型(GEMs)在人体代谢研究中扮演着关键角色【3】,它们根据基因组、生化和生理数据详细描述了代谢网络,并能预测新兴的代谢特性。近年来,随着WBMs的出现,代谢研究迈向了新的阶段,涵盖了性别和器官的差异,可用于个性化分析【4】。然而,针对婴儿代谢的模型仍有待完善,现有模型无法进行基于器官水平的通量分析,也缺乏特定能量需求的考量。基于细胞、器官特异性和WBMs常规评估的通量平衡分析(FBA)能够预测IMDs的生物标志物【5】。因此,这些代谢模型的综合应用在IMDs生物标志物研究中具有巨大的潜力。
婴儿-WBMs的建立
首先,研究人员选择出生0至6个月的婴儿作为研究对象,建立了性别特异性的新生儿和婴儿代谢模型(婴儿-WBMs)。模型综合考虑了婴儿代谢、生理和营养方面的差异,包括器官生长、性别因素、婴儿器官重量和血流供应率、以及其他特定的生理参数和营养供应。此外,研究人员根据新生儿血液代谢物浓度对模型进行了调整,确保代谢物浓度在合理范围内。模型共包括30个女性婴儿-WBM和28个男性婴儿-WBM,全面地反映了婴儿的代谢、生理、能量和营养特征。
婴儿-WBMs用于生长预测
随后,研究人员对婴儿-WBMs的预测结果与实际婴儿生长情况进行了比较,并计算了不同性别的生长曲线,考虑了婴儿器官生长的影响。结果显示,在180天时,模型预测的器官重量与实际数据相符,证实了模型的准确性。婴儿-WBM能够全面评估器官、亚系统和反应水平上的代谢通量,展示出男性和女性婴儿-WBMs在器官、反应和能量需求上的差异。研究人员以男性婴儿-WBM的验证结果为例进行了讨论。他们通过WBMs准确预测了婴儿的水分流失情况,其中尿液排泄占主要部分。预测的水分排泄在0-6个月的婴儿中与实际情况表现出高度的一致性。婴儿-WBMs能够准确捕捉水的产生与消耗,尽管与测量值略有差异,但仍展现出其对水平衡的准确预测。婴儿-WBM的能量平衡描述了婴儿体内能量的摄入和利用情况。该模型能够将不同的能量需求分配给特定器官以满足其各自的功能,研究人员预测了器官成长和发育过程中的ATP合酶的通量变化。结果显示,脑ATP合酶的预测通量值最高,其次是肝脏。研究还检查了不同器官中ATP合酶通量值随时间的变化,结果表明肌肉中ATP合酶通量的增幅最大,脑部和肝脏ATP合成增加明显,而脂肪组织较少;活跃的Cori循环为婴儿活动提供能量需求。
婴儿-WBMs用于IMDs预测
新生儿筛查计划的目标是通过早期检测可治疗的罕见疾病,减少婴儿死亡率。研究人员利用新生儿筛查数据生成了个性化的婴儿-WBMs,其中包含29种代谢物,并将它们映射到血液组分中。这些模型结合了出生体重、性别及特定时间点的代谢物浓度数据。通过对10,000名男性新生儿的抽样研究,研究发现大多数婴儿出生体重在1,770至5,590克之间,模型预测的每日生长速率在1.0089至1.0092之间,相当于每天增加0.89至0.92%的体重。少数预测结果显示婴儿体重减轻,这与排尿造成的液体流失有关。随后,研究人员进一步探究了导致新生儿体重减少的代谢原因,发现血液中精氨酸浓度低与体重减少相关,而增加精氨酸可以促进婴儿体重增长。尽管营养算法未找到其他促进体重增长的膳食补充剂,相关研究指出母乳喂养、基因突变和肠道微生物组成可能会影响精氨酸水平。这些分析结果展示了如何将新生儿筛查代谢组数据应用于个性化婴儿-WBM,以研究新出现的代谢特性。单基因缺陷可能导致IMDs,虽然罕见,但涉及的基因种类广泛,为生物标志物的研究提供了机会。研究表明,婴儿代谢网络覆盖了43%的IMD相关基因,其中脂肪酸、酮体代谢、以及能量代谢紊乱等方面覆盖最广。通过苯丙酮尿症(PKU)的预测实例,研究展示了婴儿-WBM模型对IMDs的预测能力,并表现出较高的准确性。对于PKU、异戊酸尿症、戊二酸尿症等IMDs,婴儿-WBMs模型均能正确预测其生物标志物的通量变化。这些研究结果表明,婴儿-WBMs在预测IMDs生物标志物方面具有潜力,可能对新生儿筛查和IMDs患者的生化测试具有重要价值。因此,婴儿-WBMs有望成为研究和诊断IMDs的有效工具。最后,研究人员分析了婴儿-WBMs对PKU饮食干预的反应。研究结果展示了不同饮食策略对婴儿-WBMs模型的影响,包括降低苯丙氨酸摄入和增加酪氨酸摄入等。结果显示这些干预措施对预测的代谢通量产生了显著影响,尤其是在降低苯丙氨酸摄入时。总之,这些应用案例展示了婴儿-WBMs如何用于测试和设计基于饮食治疗的IMDs饮食策略,并且这些策略可以实现个性化,为患者提供更好的管理和治疗。
综上所述,该研究介绍了婴儿-WBMs,这是一种考虑性别特异性和器官差异的婴儿代谢模型资源,可预测婴儿出生后0至6个月的生长情况,并能准确预测IMDs中血液生物标志物的变化,为新生儿和婴儿代谢研究提供了重要资源。
模式图(Credit: Cell Metabolism)
参考文献
1. Prendergast, A.J., and Humphrey, J.H. (2014). The stunting syndrome in developing countries. Paediatr. Int. Child Health 34, 250-265.
2. Sharma, V., and McNeill, J.H. (2009). To scale or not to scale: the principles of dose extrapolation. Br. J. Pharmacol. 157, 907-921. https://doi.org/10.1111/j.1476-5381.2009.00267.x.
3. Thiele, I., and Fleming, R.M.T. (2022). Whole-body metabolic modelling predicts isoleucine dependency of SARS-CoV-2 replication. Comput. Struct. Biotechnol. J. 20, 4098-4109. https://doi.org/10.1016/j.csbj.2022.07.019.
4. Thiele, I., Sahoo, S., Heinken, A., Hertel, J., Heirendt, L., Aurich, M.K., and Fleming, R.M. (2020). Personalized whole-body models integrate metabolism, physiology, and the gut microbiome. Mol. Syst. Biol. 16, e8982. https://doi.org/10.15252/msb.20198982.
5. Orth, J.D., Thiele, I., and Palsson, B.Ø. (2010). What is flux balance analysis? Nat. Biotechnol. 28, 245-248. https://doi.org/10.1038/nbt.1614.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


