Nat Commun | 安徽医科大学王华教授等团队合作发现父源性不育症发病新机制
来源:生物探索 2024-02-17 10:45
研究发现,多代父体肥胖通过增加METTL3介导的精子m6A水平,逐渐加重镉诱导子代睾丸Wt1下调和精子发生障碍。
安徽医科大学王华教授等团队在Nature Communications(IF 16.6)在线发表题为“Multigenerational paternal obesity enhances the susceptibility to male subfertility in offspring via Wt1 N6-methyladenosine modification”的研究论文(王华教授、徐德祥教授和贺小进教授为本文共同通讯作者,公共卫生学院熊永伟博士、朱华龙博士、张进博士和耿浩博士为本文共同第一作者),该研究发现多代父体肥胖通过Wt1 N6-甲基腺苷修饰升高男性子代低生育力易感性。
该研究在成功建立父源性不育症动物模型基础上,发现多代父体肥胖升高子代精子发生障碍易感性;基于m6A-mRNA&lncRNA表观转录组芯片、RNA测序以及生物信息学分析,发现多代父体肥胖降低子代睾丸Wt1表达和升高其m6A修饰水平;通过睾丸局部注射AAV9-Wt1,揭示Wt1下调介导的视黄酸信号受阻在多代父体肥胖加重子代精子发生障碍易感性中发挥关键作用;通过体内m6A修饰抑制剂STM2457处理和体外Mettl3 siRs,阐明精子源m6A修饰水平升高对多代父体肥胖下调子代睾丸Wt1表达的影响;最后,基于人群病例-对照研究验证精子m6A水平与体质指数存在正向关联,与精液质量存在负向关联。
总之,多代父体肥胖通过下调Wt1 mRNA表达,逐渐升高子代精子发生障碍易感性,且METTL3介导的精子m6A修饰参与父体肥胖引起子代睾丸Wt1 mRNA稳定性降低。该研究结果为筛选父体不良因素暴露损害子代精子发生的表观遗传标志物提供实验证据,也为今后制定父源性不育症的早期防治策略提供重要参考。

据WHO报道,不孕不育已成为继心血管疾病和肿瘤之后威胁人类健康的第三大疾病。国内外多项大样本调查发现,一般人群中男性不育症患病率高达9.0%~25.0%。已知,精子质量是评价男性生育能力的重要标志。然而,在过去45年间(1973至2018),全球男性精子质量下降已超过62.0%。肥胖是精子质量下降的重要危险因素,但过去研究更多关注当代肥胖对精子质量的影响。健康与疾病的父系起源(POHaD)理论认为,父体暴露不良因素导致成年后代慢性疾病的发生和发展。已有研究发现,父体肥胖损害子代睾丸生精小管结构,减少附睾精子数量。但是,多代父体肥胖对子代精子发生障碍易感性的影响及其机制尚不清楚。
N6 -甲基腺苷(N6 -methyladenosine,m6A)是真核生物RNA上最为常见的修饰,其主要发生在RRACH(R=G/A;H=U/A/C)基序中,调节RNA剪接、降解、稳定性和翻译等转录后过程。在哺乳动物中,m6A修饰由RNA甲基化酶和去甲基化酶动态调控,甲基化酶主要包括METTL3、METTL14和WTAP等,去甲基化酶主要包括ALKBH5和FTO等。另外,m6A修饰转录本通过阅读蛋白影响RNA命运。众多研究结果表明,m6A修饰动态平衡在调控睾丸发育和精子发生过程中起关键作用。我们之前研究证明,高脂饮食显著升高小鼠睾丸m6A修饰水平。然而,多代父体肥胖对子代睾丸m6A修饰水平的影响知之甚少。
众所周知,在父系获得性表型传递过程中,精子扮演着不可或缺的作用。前期研究发现,精子表观遗传修饰如非编码RNA、组蛋白修饰、DNA甲基化和RNA甲基化等,参与父系获得性疾病的代际传递。也有研究表明,从胚胎期至成年期,小鼠睾丸m6A修饰水平持续升高。但是,父代精子m6A修饰改变是否持续影响到子代睾丸,进而介导多代父体肥胖升高子代精子发生障碍易感性仍需进一步探讨。
为了解决以上问题,研究通过动物实验、细胞研究以及人群调查相结合思路阐明多代父体肥胖对子代精子发生障碍易感性的影响及其m6A修饰机制。首先,建立多代父体高脂饮食小鼠模型,用于研究子代对镉(一种常见生殖毒性诱导剂)诱导精子发生障碍易感性的影响。结果发现,多代父体高脂饮食逐渐降低子代小鼠生育能力,并加重镉降低子代小鼠精子数量和精子活力。随着父体高脂饮食代数增加,子代小鼠睾丸成熟期生精小管数量以及睾丸生殖细胞标志物表达水平也逐渐减少。以上结果提示,多代父体肥胖升高子代小鼠精子发生障碍易感性。

多代父体肥胖升高子代精子发生障碍易感性(Credit: Nature Communications)
为了进一步探讨多代父体肥胖升高子代精子发生障碍易感性的原因,对子代睾丸进行RNA测序。结果提示,多代父体高脂饮食诱发的子代睾丸差异表达基因与视黄醇代谢过程有关。随着父体高脂饮食代数增加,子代睾丸视黄酸(RA)以及视黄酸合成酶Aldh1a1/2/3水平逐渐降低。通过ChEA3数据库预测视黄酸合成酶上游转录因子发现,WT1评分最高。随后研究结果显示,多代父体高脂饮食逐渐加重镉下调子代睾丸Wt1表达。此外,WT1过表达显著逆转父代高脂饮食减少子代精子数量,恢复父代高脂饮食降低子代睾丸RA水平和ALDH1A1蛋白表达水平。因此,上述结果表明多代父体肥胖通过抑制Wt1介导的视黄酸合成,逐渐升高子代睾丸精子发生障碍易感性。
为了确定Wt1 mRNA下调机制,该研究进行m6A-mRNA&lncRNA表观转录组芯片及相关实验。结果发现,多代父体高脂饮食逐渐加重镉升高子代睾丸甲基化酶METTL3表达和Wt1 m6A修饰水平,加重镉下调子代睾丸阅读蛋白IGF2BP1表达。Mettl3 siR明显逆转镉升高支持细胞Wt1 m6A修饰水平,缓解镉降低支持细胞Wt1 mRNA和蛋白水平。Igf2bp1 siR显著加重镉升高支持细胞Wt1 mRNA降解率。荧光素酶报告基因结果显示,镉通过甲基化Wt1 site1位点下调其mRNA表达。IGF2BP1-RIP实验证实,镉暴露降低支持细胞IGF2BP1与Wt1 mRNA的结合能力。上述结果表明,多代父体肥胖以m6A依赖方式逐渐加重镉降低子代小鼠睾丸Wt1 mRNA稳定性。
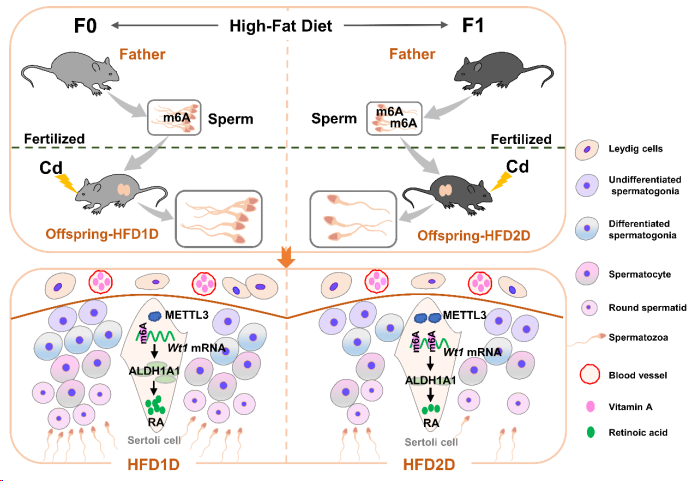
模式图(Credit: Nature Communications)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


