CD3/BCMA双抗,制药巨头的必争之地
来源:医药魔方 2022-12-09 16:53
多发性骨髓瘤(MM)是一种无法治愈的血液肿瘤。当出现恶性病变时,存在于骨髓中的浆细胞迅速扩散并取代骨髓中的正常细胞。2020年,全球大约有17.6万人被诊断出患有多发性骨髓瘤。2022年,预计美国将有
多发性骨髓瘤(MM)是一种无法治愈的血液肿瘤。当出现恶性病变时,存在于骨髓中的浆细胞迅速扩散并取代骨髓中的正常细胞。2020年,全球大约有17.6万人被诊断出患有多发性骨髓瘤。2022年,预计美国将有超过3.4万人确诊,并且超过1.2万人将死于该病。
2015年强生CD38单抗Darzalex(达雷妥尤单抗)的批准使MM的治疗从以硼替佐米、卡非佐米、伊沙佐米为主的蛋白酶体抑制剂(PI)和以泊马度胺、来那度胺为主的免疫调节剂(IMIDs)等小分子跨进大分子治疗时代。
近几年,多发性骨髓瘤迎来多款生物药批准,赛诺菲CD38单抗isatuximab已获批MM二线治疗,强生/传奇生物BCMA CAR-T(西达基奥仑赛,Carvykti),强生的CD3/BCMA双抗(teclistamab)、百时美施贵宝的BCMA CAR-T(idecabtagene vicleucel)以及GSK/Seagen的BCMA抗体偶联药物belantamab mafodotin(近期被FDA责令撤市)均获批治疗至少接受过4线疗法的MM患者。
巨大的临床需求推动了MM市场的快速增长,2019年,全球多发性骨髓瘤市场超过200亿美元,且仍处在高速增长期。其中,强生的Darzalex一路高歌猛进,从最初的4线以上治疗覆盖至一线治疗,已经成为了年销售额高达60.23亿美元的重磅炸弹。
前段时间,强生teclistamab凭I/II期数据先后获欧盟和美国FDA批准上市,用于治疗复发或难治性多发性骨髓瘤(r/r MM)。teclistamab不仅是全球首款获批的CD3/BCMA双抗,同时也是双特异性抗体药物在MM领域的首次批准。
数据方面,164例既往接受中位5线治疗患者经teclistamab治疗后的客观缓解率(ORR)达63%(104/165),58.8%获得非常好的部分缓解或更好缓解(≥VGPR),39.4%获得很好的完全缓解(CR);中位持续缓解时间(DOR)为18.4个月,中位无进展生存期(PFS)为11.3个月,中位总生存期(OS)为18.3个月。
本届ASH年会上,多家制药巨头公布了自家CD3/BCMA双抗治疗MM的进展。包括辉瑞的Elranatamab、百时美施贵宝的Alnuctamab、艾伯维的Abbv-383以及再生元的REGN5458。
接下来,我们一起来看看另外4家跨国药企CD3/BCMA双抗治疗MM的疗效数据:
产品名称:Elranatamab
公司:辉瑞
辉瑞的Elranatamab目前处于III期临床阶段,是继强生teclistamab之后,进展最快的D3/BCMA双抗。本次大会上,辉瑞公布了2项关于Elranatamab的临床结果。
MagnetisMM-1是正在进行的首个人体研究,截至2022年6月22日,共有55名患者接受了elranatamab(≥215μg/kg,SC)单药治疗。患者既往治疗中位线数为5(范围2-14)。
中位随访12.0个月(范围 0.3-29.0),根据国际骨髓瘤工作组(IMWG)确认的ORR为64%,56%患者达到VGPR或更好,38%(21/55)达到CR或更好。即使之前接受过BCMA靶向治疗(抗体药物偶联物、嵌合抗原受体T细胞治疗或两者)的13名患者中,也获得54% (7/13) 的缓解,其中46% (6/13)获得了VGPR或更好,初步证明了elranatamab仍具备了抢夺BCMA靶向疗法难治性患者的潜力。
最常见的TEAE包括CRS、中性粒细胞减少、贫血、注射部位反应和淋巴细胞减少。推荐剂量(1000µg/kg或76mg)的CRS总发生率为67%,仅限于1级 (33%) 或2级(33%),没有3级或更高级别的事件。
另一项代号为Magnetismm-3研究的Cohort A评估了elranatamab在既往无BCMA靶向治疗史患者中的疗效。结果显示,中位随访6.8个月(范围0.2~ 16.2)时,BICR评估的ORR为61.0% (95% CI为51.8 ~ 69.6);各亚组均观察到临床获益。在应答者中,达到客观缓解的中位时间为1.2个月(范围为0.9~ 6.9)。客观缓解的中位持续时间尚未达到,6个月持续缓解的概率为90.4% (95% CI, 79.8~95.6)。
产品名称:Alnuctamab
公司:百时美施贵宝
BMS汇报了其CD3/BCMA双抗Alnuctamab(ALNUC)治疗MM首个人体研究的静脉注射(IV)长期随访数据以及皮下注射(SC)的初步数据。
截至2022年5月31日数据截止,70例患者接受静脉ALNUC治疗,39%(27/70)达到客观缓解,mPFS为13.3周(95% CI, 8.1-23.9)。获得静脉ALNUC缓解的患者mDoR为146.1周(95% CI, 40.6-NE)。
47例患者接受SC ALNUC剂量递增(10mg: n=6;15mg: n=4;30mg:n=6;60mg:n=3)和剂量扩展(10mg:n=9;30mg:n=9)治疗。在2022年5月31日数据截止时,中位随访时间为2.6个月(范围:0-11.4),68%(n=32)的患者继续接受SC ALNUC治疗。
41名患者疗效可评估,总人群ORR为51%(21/41),剂量≥30mg患者ORR为77%(10/13)。mDoR为4.3周(范围4.1-17.4),所有21例缓解(100%)均在持续中。

任何级别或者3-4级TEAE发生率分别为89%和62%;最常见的是CRS(53%/0%)、中性粒细胞减少症(34%/30%)和贫血(34%/17%)。所有CRS事件限制在1级(21例;45%)或2级(4例;9%)。1例1级免疫效应细胞相关神经毒性事件。无因不良事件停止治疗的患者,没有发生与治疗相关的死亡事件。
产品名称:Abbv-383
公司:艾伯维
艾伯维公布了CD3/BCMA双抗Abbv-383一项I期、开放标签剂量递增(ESC)和剂量扩展(EXP)研究更新数据,截至2022年1月8日,124例患者接受了治疗:ESC组73例(0.25-12mg;40mg,n=6;60mg, n=9)和EXP组51例(60mg)。
40mg(ESC)和60mg(ESC+EXP)组中位随访时间分别为17.4和8.4个月,分别有50%和45%的患者正在继续接受治疗。所有3名40mg ESC组患者和33名60mg ESC+EXP组患者中的23患者因疾病进展而停药。
总人群ORR (N=122)ORR为57%,40mg(ESC)组(n=6)ORR为83%,60mg ESC+EXP组(n=58)ORR为60%。
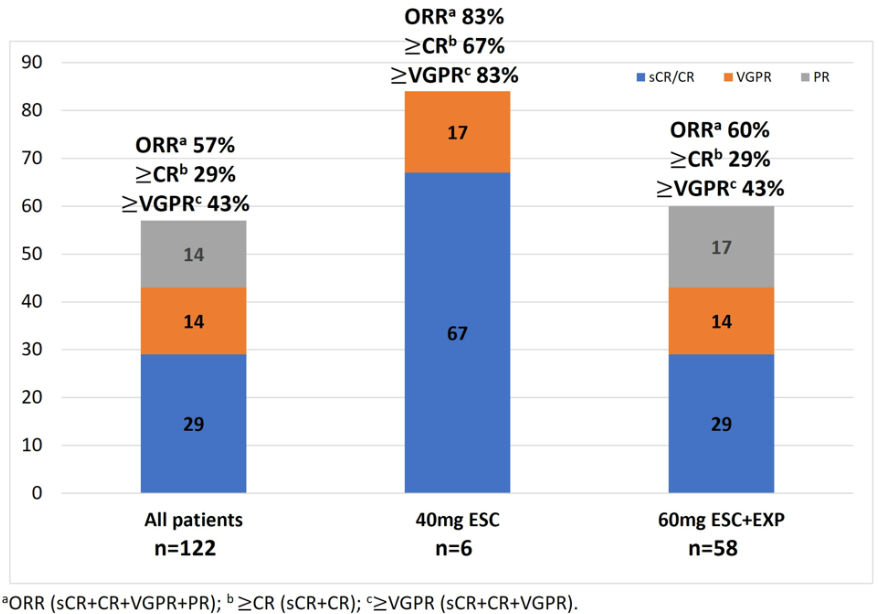
40mg ESC队列三重耐药亚群(n=4)的ORR为75%,75%患者达到VGPR或更好,50%达到CR或更好。60mg ESC+EXP组三重耐药亚群(n=48)的ORR为54%,29%达到CR或更好,40%达到VGPR或更好。Kaplan-Meier法分析,任何队列均未达到中位DOR和PFS (NR)。
在40mg (n=6)和60mg(n=60)队列中,TEAE发生率分别为100%(50% G≥3)和98% (78% G≥3),最常见为CRS:83% (0% G≥3)和72% (2% G≥3)。感染:50% (17% G≥3)和43% (22% G≥3);中性粒细胞减少:67% (67% G≥3)和40% (35% G≥3),贫血:33% (17% G≥3)和32% (12% G≥3)。
产品名称:REGN5458
公司:再生元
再生元也更新了其CD3/BCMA双抗REGN5458治疗r/r MM首个人体I/II期研究数据。截至2022年1月28日,I/II期研究中,共有167名r/r MM患者至少接受了一剂REGN5458。
共有164例(98.2%)患者发生了TEAE,其中78.4%为3级及以上。最常见的血液学TEAE为贫血36.5%(≥G3:29.9%),中性粒细胞减少28.7%(27.5%)和血小板减少21%(16.2%)。最常见(≥30%)的非血液学TEAEs为CRS 47.9%(G1 36.5%,G2 10.8%,G3 0.6%)及疲劳34.1%。
I期试验中,接受≥200mg剂量治疗患者(N=24)ORR高于接受<200mg剂量治疗的患者(N=49),分别为75%和40.8%。这一观察结果在细胞遗传风险、R-ISS分期、既往治疗和骨髓浆细胞增多水平的患者亚组中是一致的。随着时间推移,缓解加深,≥CR为37.5%。mDoR还没有达到。基于总体效益/风险概况,RP2D被确定为200mg。
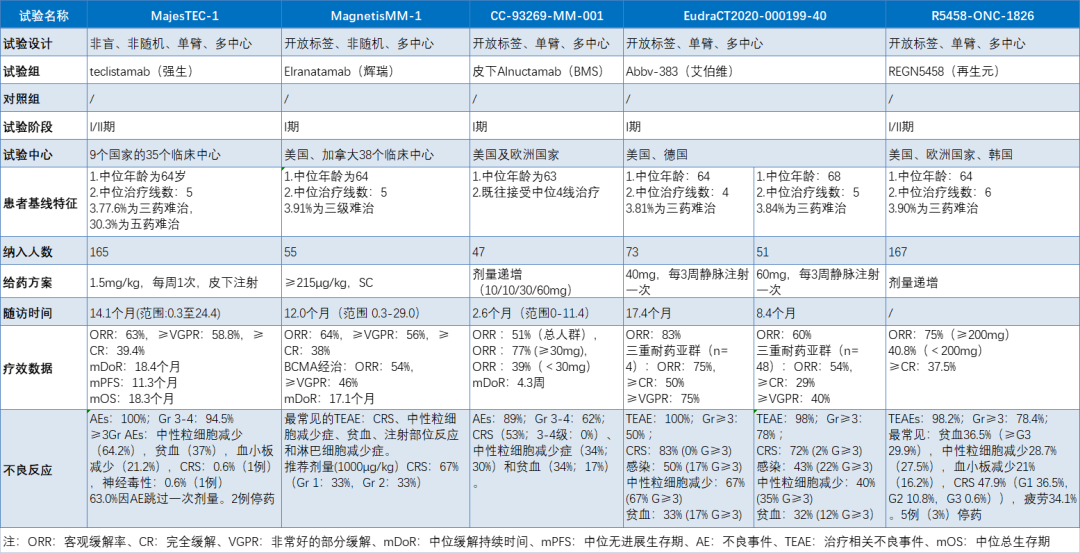
试验数据汇总:
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


