2022年全球细胞疗法十大事件
来源:医药魔方 2023-02-06 11:48
回望2022无疑是艰难的一年,资本寒冬席卷下,细胞疗法领域也经历了一些令人印象深刻的挫折或失败,但总体来说突破和进展是主旋律。
回望2022无疑是艰难的一年,资本寒冬席卷下,细胞疗法领域也经历了一些令人印象深刻的挫折或失败,但总体来说突破和进展是主旋律。我们挑选了过去一年该领域发生的十大事件,按时间顺序排列,为大家一展2022细胞疗法领域概览,以供参考。新年新气象,愿细胞疗法在新的一年继续百花齐放,收获更多硕果。
01、传奇生物西达基奥仑赛(BCMA CAR-T)在美、欧、日获批上市
传奇生物与杨森公司于2017年12月签订了全球独家许可和合作协议,以开发和商业化西达基奥仑赛(英文商品名:CARVYKTI®,英文通用名ciltacabtagene autoleucel)。这是一款具有两种靶向B细胞成熟抗原(BCMA,主要表达于恶性多发性骨髓瘤B细胞、晚期B细胞和浆细胞的表面)单域抗体的CAR-T细胞免疫疗法。
在关键的CARTITUDE-1研究中,97例R/R MM患者出现了早期、深度持久的缓解,总缓解率(ORR)高达98%,78%的患者获得了严格的完全缓解(sCR)。在18个月的中位随访时间中,中位缓解持续时间(DOR)为21.8个月。
2月28日,传奇生物在美国新泽西州萨默塞特正式宣布,其自主研发的细胞治疗产品CARVYKTI®获得美国FDA批准上市,用于治疗复发或难治性多发性骨髓瘤(R/R MM)患者,这些患者既往接受过四线或以上的治疗,包括蛋白酶体抑制剂、免疫调节剂和抗CD38单克隆抗体。
随后,CARVYKTI®分别在欧盟和日本上市:
5月26日,传奇生物宣布欧盟委员会(EC)已授予CARVYKTI® 附条件上市许可,用于治疗既往接受过至少三种治疗,包括免疫调节药物、蛋白酶体抑制剂和抗CD38抗体,并且末次治疗出现疾病进展的R/R MM成人患者。
9月27日,传奇生物宣布日本厚生劳动省 (MHLW) 已批准CARVYKTI®用于治疗R/R MM成人患者,仅限符合以下两项条件:1)患者无靶向BCMA的CAR阳性T细胞输注治疗史;2)患者既往接受过至少三线治疗,包括蛋白酶体抑制剂(PI)、免疫调节剂(IMiD)和抗CD38单克隆抗体,且对末次治疗无响应或已复发。
西奈山医学院血液肿瘤学教授、CARTITUTE-1 主要研究者Sundar Jagannath博士说:“对于大多数多发性骨髓瘤患者来说,治疗过程是一个不断缓解和复发的循环,只有较少的患者经末线治疗后获得了深度缓解。这就是为什么我对CARTITUDE-1研究的结果感到非常兴奋。该研究表明CARVYKTI®在即使经过多线治疗后的多发性骨髓瘤患者群体中,同样能提供深度持久的缓解和长期无治疗间隔。CARVYKTI®的获批有望满足这些巨大且尚未被满足的患者需求。”
02、首个CAR-Treg疗法完成患者给药
3月29日,Sangamo Therapeutics宣布在TX200的I/II期STEADFAST临床研究中完成首例患者给药。该药物是Sangamo全资拥有的自体嵌合抗原受体调节性T细胞(CAR-Treg)细胞治疗候选产品,用于预防HLA-A2不匹配活体肾移植后的免疫排斥反应。
Treg细胞是一群具有负调节机体免疫反应的T细胞,起着维持自身耐受和避免免疫反应过度损伤机体的作用,同时也参与肿瘤细胞逃避机体免疫监视。Treg细胞很早就被用于作为过继性细胞治疗开发,不过早先开发的方法主要是多克隆或体外扩增Treg,其所需细胞数量较多,同时存在非特异性免疫抑制的风险,限制了Treg的进一步应用。随着CAR技术的快速发展,CAR-Treg也成为一种热门的研究方向。目前,基于Treg细胞在免疫调节上的功能,CAR-Treg通常被开发用于治疗自身免疫性疾病。
TX200被设计为通过减少局部炎症和促进移植物免疫耐受来预防肾排斥反应。这种研究性细胞疗法正在HLA-A2阴性患者中进行评估,这些患者接受了不匹配的HLA-A2阳性肾脏。TX200细胞将定位到移植物上,并在与HLA-A2抗原结合后激活。通过其调节免疫系统的能力,TX200细胞可以保护移植物免受免疫介导的排斥反应,并减少或消除使用免疫抑制剂终生治疗的需求。
Sangamo的首席执行官Sandy Macrae表示:“非常感谢患者和研究人员参与了我们认为的有史以来首次给人体使用CAR-Treg细胞治疗候选药物。我们相信CAR-Treg是细胞治疗的下一个前沿领域,代表了实体器官移植以及许多具有挑战性的自身免疫和炎症疾病的潜在变革性治疗方法。STEADAST I/II期研究是基因组医学的一个重要里程碑,我们预计这将产生关于CAR-Treg生物学的见解,并可能通过促进对移植物的免疫耐受,帮助接受供体捐赠的HLA-A2错配肾脏的患者更好生存。”
CAR-Treg细胞赛道已然开启。目前,CAR-Treg细胞已经逐渐在实现临床转化,更是有不少企业都在积极布局该新型领域。近年来,国外已有多家专注于CAR-Treg的生物技术公司成立,并且筹集了数亿美金。
03、红细胞疗法疗效差强人意,领头羊公司Rubius “断尾续命”
2022年4月8日,红细胞疗法“领头羊”Rubius在AACR年会上公布其领先产品RTX-240在实体瘤的临床I期数据。尽管安全性数据良好,但有效性结果差强人意,27例可用于有效性统计的患者中仅3例PR(1例确认、2例未确认)。该事件导致公司股价跳水,当日跌幅超40%。
面对效果不佳的领先产品和现金流短缺,“活下去”成了Rubius最大的目标。根据公告,Rubius宣布中止两款主要的红细胞药物RTX-240和RTX-224在实体肿瘤中的开发,并将裁员75%(波及人员多数与两款产品的研发有关)。公司计划重组资源,放弃原本的制造工艺,推进下一代基于成熟红细胞的偶联技术平台。
Rubius的策略转变让业界的目光聚焦到了成熟红细胞疗法上。提及该疗法就不得不提到科镁信生物医药联合创始人史家海,他在2021年初成功开发了下一代成熟红细胞疗法。
史博士曾在MIT Whitehead 研究所Harvey Lodish教授实验室从事博士后工作时开创了完整红细胞疗法。第一代完整红细胞疗法是基于造血干细胞基因改造的工程化红细胞,这也是Harvey Lodish后来创立Rubius的根基之一。2015年,史博士回到香港城市大学继续下一代成熟红细胞疗法技术开发并获得成功,该技术不再需要造血干细胞,而是直接利用在成熟红细胞表面共价链接效应分子,使之伪装成抗原呈递细胞来激活抗肿瘤免疫细胞,或者携带自身免疫抗原以抑制超敏反应。
相对于第一代技术,下一代成熟红细胞疗法没有对红细胞造成损害,显著地提高红细胞药物在体内的半衰期,同时能更好地控制每个红细胞的载药量和载药种类。加上新一代工艺原材料使用血库捐献血,不涉及干细胞分化或基因工程,可大大降低制造成本。
Rubius的转变也进一步证明了布局成熟红细胞疗法的科镁信、西湖生物等在该赛道上的领先和前瞻性。
04、CAR-NK细胞疗法初步临床结果积极,Nkarta股价大涨140%
4月25日,Nkarta公司公布旗下两款CAR-NK细胞疗法积极的I期临床数据,使得其股价暴涨140%。
Nkarta此次公布的是NKX101(靶向NKG2D)和NKX019(靶向CD19)治疗血液瘤的初步临床数据。两款产品安全性相对不错,并且初步治疗效果也很值得期待。
第一个试验评估了NKX101在复发/难治性(r/r)急性髓系白血病(AML)和高风险骨髓增生异常综合征(MDS)患者中的疗效, 5例接受高剂量NKX101的AML患者中有3例完全缓解(60% CR),其中两例微小残留病灶(MRD)为阴性。目前这些患者没有标准治疗手段。
第二个试验评估了NKX019在r/r B细胞恶性肿瘤患者的疗效,6例患者中有3例在3剂量方案中接受了高剂量治疗,显示出完全缓解(50% CR),包括1例侵袭性弥漫大B细胞淋巴瘤和1例套细胞淋巴瘤患者。值得一提的是,12月5日Nkarta报道的最新结果显示,10例接受中或高剂量NKX019治疗的非霍奇金淋巴瘤患者中有7例获得了完全缓解(CR为70%),临床应答率与自体CAR-T非常相似。
Nkarta此次数据公布,展现了NKG2D CAR-NK治疗AML良好的耐受性、安全性和高度活性。此前,Nkarta已报道NKX101局部输注治疗肝癌和转移性肠癌的临床前研究结果,其治疗实体肿瘤的潜力同样值得期待。
05、mRNA改造CAR单核细胞疗法完成首例患者给药
5月11日,美国临床阶段生物技术公司Myeloid Therapeutics宣布,在I/II期临床研究IMAGINE中,完成了MT-101首例复发/难治性外周T细胞淋巴瘤(PTCL,一种侵袭性非霍奇金淋巴瘤)患者给药。这也是首次mRNA改造的CAR单核细胞(CAR-M)疗法完成患者给药。
MT-101是来源于该公司专有ATAK™平台的首个mRNA工程化单核细胞,靶向CD5,一种存在于许多T细胞恶性肿瘤中的表面受体。ATAK平台旨在利用髓系细胞的先天能力:髓系细胞的天然免疫监视和运输能力使其在发现癌症转移方面特别有利,这对于许多晚期患者来说尤其重要。ATAK™ CAR是该公司专利,专门设计用于促进广泛的抗肿瘤活性。此外,Myeloid为其ATAK细胞疗法候选药物开发了一种专有的、流线型制造工艺,单日便可完成制造。与同种异体方法相比,该过程为患者和CDMO提供了显著优势。
IMAGINE(NCT05138458)是一项多中心、开放标签、剂量递增和剂量队列扩展I/II期临床试验,评估难治/复发性PTCL患者的MT-101治疗。在这项临床试验中,首例完成给药的患者在接受治疗28天时,未发现剂量限制性毒性,无细胞因子释放综合征(CRS)和免疫效应细胞相关神经毒性综合征。
Myeloid的首席医学官 Michele Gerber说:“很高兴宣布在IMAGINE临床试验中开始给药,这代表着我们为复发/难治性PTCL患者提供CD5 ATAK细胞治疗努力的一个重要里程碑。目前,我们正在继续进行评估MT-101在PTCL患者中的安全性和耐受性、最佳剂量方案、肿瘤穿透性和初步疗效的IMAGINE剂量递增队列研究。在I期研究结束后,我们将快速进入该研究的II期阶段,以支持MT-101的注册。
06、开创多个第一!诺奖得主公司“现货型”CAR-T单次治疗实现100%ORR
5月12日,Caribou Biosciences宣布了其同种异体抗CD19 CAR-T细胞疗法,在治疗复发/难治性B细胞非霍奇金淋巴瘤(r/r B-NHL)患者的ANTLER研究I期积极初步结果。队列1(5例患者可评估)的总缓解率(ORR)达100%,完全缓解率(CR)达80%。
这项研究开创了多个第一:1)CB-010是临床上首个使用PD-1基因敲除的“现货型”CAR-T细胞疗法;2)这是CB-010首次在r/r B-NHL患者中进行的人体试验;3)CB-010是第一个实现100%ORR的同种异体CAR-T细胞疗法。
Caribou总部位于美国加利福尼亚州,是一家领先的临床阶段CRISPR基因编辑生物技术公司,其联合创始人之一Jennifer Doudna曾在2020年因CRISPR 获得诺贝尔化学奖。Caribou起源于Doudna在加州大学伯克利分校的实验室,公司现任首席执行官Rachel Haurwitz是Doudna首位研究CRISPR的研究生。2011 年,她们与James Berger和Martin Jinek一同创立了该公司。Caribou正在开发一系列“现货型”CAR-T和CAR-NK细胞疗法,用于治疗血液系统恶性肿瘤和实体瘤。
CB-010是Caribou同种异体CAR-T细胞治疗平台的领先候选产品,目前正在ANTLER I期临床试验中被评估用于治疗r/r B-NHL。CB-010使用Cas9 CRISPR杂交RNA-DNA(chRDNA)技术将CD19特异性CAR插入TRAC基因,并敲除PD-1以增强抗肿瘤活性的持久性。

来源:Caribou官网
07、Iovance首款TIL疗法即将上市,股价却腰斩
Iovance Biotherapeutics是最早开始研发肿瘤浸润淋巴细胞(TIL)疗法的企业之一, 其拥有一系列TIL疗法产品管线,且数款候选药物均已进入临床II期试验,是当之无愧的行业领军企业。Iovance领先产品Lifileucel的生物制品许可申请(BLA)已 于2022年4月1日获得美国FDA的积极反馈,因此有望成为全球首个获批的TIL疗法。
5月27日, Iovance披露了Lifileucel治疗晚期黑色素瘤的临床研究(C-144-01)结果。该研究旨在评估lifileucel在晚期(不可切除或转移性)黑色素瘤患者的疗效,这些患者既往接受过抗PD-1/L1治疗,如果BRAF突变阳性,也曾接受过BRAF或BRAF/MEK抑制剂治疗。
在注册性队列4(n=87)中, 客观缓解率(ORR)为29%,3例完全缓解(CR),22例部分缓解(PR)。中位缓解持续时间 (DOR) 为10.4个月,中位随访时间为23.5 个月。此结果得到队列 2 (n=66) 研究结果的支持:ORR为35%,5例CR和18例PR。队列 2 的中位DOR未达到,中位随访时间为36.6个月。队列 2 和 4合并患者 (n=153) 的ORR为31%,并且在中位研究随访27.6个月时未达到中位DOR。然而本次结果公布并未让投资人满意,导致Iovance股价腰斩。
事实上,Iovance关于lifileucel的开发进展并不顺利:
1)lifileucel项目原计划在2020年底提交上市申请,但在2019年10月召开的会议上,Iovance未能就lifileucel治疗转移性黑色素瘤所需的效力分析与FDA达成一致,因此上市申请计划从2020年底推迟至2021年。
2)2021年5月,Iovance再次收到FDA要求提供lifileucel药效分析额外数据的回复函,以确保每一批TIL产品符合标准。这一挫折使Iovance的BLA的提交推迟至2022年上半年。受此影响,Iovance股价下跌了6.79%。当天此消息发布不到20小时,该公司任职5年的首席执行官Maria Fardis博士表示将离职,这令投资者感到恐慌,Iovance的股价因此下跌了36%。
3)最新消息显示,由于FDA要求提供更多信息,Iovance向FDA滚动提交lifileucel的BLA完成时间预计将延长至2023年第一季度。受此消息影响,Iovance 股价再度下跌。
好事多磨,新药研发上市之路充满艰辛,不过Iovance递交滚动上市申请也为TIL细胞药物的未来展现了更多可能性。国内方面,近期也不断迎来喜讯,砂砾生物、君赛生物TIL疗法IND获批、智瓴生物、循生医学TIL疗法临床申请获得受理等,这些讯息标志着我国TIL细胞药物开发商业化驶入快车道。
08、超60亿美元合作,罗氏入局“现货型”CAR-T疗法
8月3日,美国临床阶段生物制药公司Poseida Therapeutics宣布与罗氏(Roche)达成了全球战略合作与许可协议,将共同开发针对血液瘤的通用型CAR-T疗法,涵盖多发性骨髓瘤、B细胞淋巴瘤以及其他血液适应症。根据该协议,Poseida公司将获得1.1亿美元的预付款,加上里程碑以及其他付款总额可能高达60亿美元。这也是2022年细胞疗法领域金额最高的“License in”交易。在与罗氏合作的消息发布之后,Poseida的股价暴涨了85%。
该公司的CAR-T细胞不含有单链可变片段(scFv)结构,而是由全人源的Centyrin结构域组成。这是一种小型、简单、高度稳定的蛋白质,能以很高的特异性和亲和力结合目标抗原,在稳定性高的同时具有低免疫原性。
不同于传统的病毒载体系统,Poseida专有的piggyBac DNA修饰系统使用非病毒载体将CAR分子基因递送给T细胞,可以产生具有高百分比T记忆干细胞(TSCM细胞)的CAR-T产物。TSCM细胞具有自我更新能力和多能性,高TSCM细胞占比可以使候选药物更有效、毒性更小、更耐用;非病毒载体制造成本低、生产时间短、诱变和肿瘤发生的风险低;同时,PiggyBac的载货量可达慢病毒载体的20倍,可以有效递送超大片段基因,实现稳定的转基因表达。
此外,Poseida使用Cas-CLOVER系统敲除CAR-T细胞中多种T细胞关键抑制信号的受体,可以保证CAR-T细胞的活化状态。该系统能有效的避免TALEN技术只能用于激活的细胞的使用限制性和CRISPR/Cas9可能的脱靶突变带来的潜在安全风险。
综合来看,Poseida的在研产品旨在解决其他CAR-T疗法的局限性,包括反应持续时间、治疗实体肿瘤的能力和安全性问题,其转染、编辑以及递送平台都有独特优势,可能带来成本更低、生产时间更短的CAR-T疗法,解决当下的瓶颈。
09、全球首个!工程化 B 细胞疗法获批临床
9月1日,Immusoft宣布,FDA已批准其工程化B细胞疗法ISP-001用于黏多糖贮积症I型的临床试验申请。该公司的ISP™方法可重新编程患者的B细胞,以不断生产治疗性蛋白,从而减轻频繁输液,并有可能改善患者预后。ISP-001是公司专利技术开发的首个候选产品。该药物已获得FDA孤儿药物认定。如果进展顺利,ISP-001将成为全球首款进入临床试验的工程化B细胞疗法,这一疗法获批临床对于Immusoft而言是一个重要的里程碑。
工程化B细胞疗法是一个相对冷门的赛道,随着CAR-T、TCR-T、NK等不同类型细胞疗法在临床治疗展现出令人瞩目的疗效,近几年才有公司将目光投向工程化B细胞疗法。
与生命周期较短的T细胞不同,B细胞作为一种长寿浆细胞,能够存活数十年并产生大量的抗体,这意味着B细胞疗法有更好的持久性。然而实际操作中原代人类B细胞的体外培养、扩增、修饰和分化都受到了技术的限制,因此工程化B细胞就成为了解决办法。
虽然该赛道刚刚起步,但不可否认B细胞疗法具有较大潜力,深耕B细胞疗法或许能走出一条差异化道路。
10、里程碑!全球首个通用型T细胞免疫疗法获批上市
12月19日,Atara Biotherapeutics和Pierre Fabre联合宣布,欧盟委员会(EC)批准其免疫疗法Ebvallo(tabelecleucel)上市,作为单药治疗EB病毒(EBV)相关的移植后淋巴增殖性疾病(EBV+PTLD),病患包含曾至少接受过一次前期治疗的成人与2岁以上儿童患者。根据新闻稿,这是全球首项获批的同种异体T细胞免疫疗法。
EBV+PTLD是淋巴瘤的一种,是一种罕见、急性可能致死的血液癌症,可能在实体器官移植(SOT)或同种异体造血细胞移植(HCT)后发生。一线治疗失败的HCT后EBV+PTLD患者的中位总生存期为0.7个月,SOT后为4.1个月。这些患者有着显著的未竟医疗需求。
Ebvallo是一款现货型同种异体T细胞免疫疗法,以人类白细胞抗原(HLA)限制的方式靶向受EBV感染的细胞。该疗法除了针对利妥昔单抗治疗失败的移植后EBV+PTLD患者,还计划用于治疗包括鼻咽癌在内的其他EBV相关血液癌症和实体瘤。2015年2月,美国FDA授予Ebvallo用于治疗HCT后产生EBV+PTLD的突破性疗法认定(BTD)。此疗法亦获得欧盟孤儿药资格与PRIME资格。
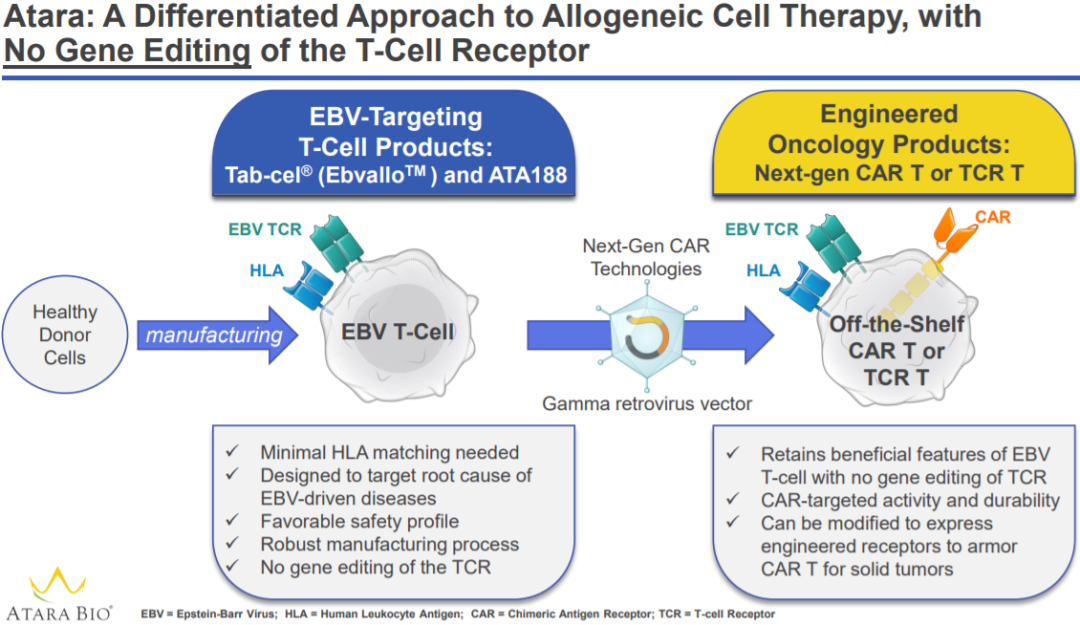
来源:Atara Bio官网
Atara的总裁兼首席执行官Pascal Touchon博士表示:“Ebvallo在欧盟的获批对于那些具显著未竟医疗需求的患者而言是一项医疗上的突破。这是获全球监管单位首次批准的同种异体T细胞免疫疗法,这对Atara以及我们在欧洲的合作伙伴Pierre Fabre,甚至是整个细胞疗法领域而言是个历史性的时刻。”
以上便是本次挑选的2022年细胞疗法领域十大事件。当然,过去一年,细胞疗法赛道值得关注的重要事件还有很多,欢迎大家留言补充。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


