小核酸药物: 气管内注射LNA修饰的反义寡核苷酸诱导小鼠肺成纤维细胞基因沉默
来源:生物谷原创 2022-09-13 10:33
反义寡核苷酸(ASO)治疗药物通常长度为16-20个核苷酸,由化学修饰的核苷酸组成,位于DNA中央部分的两侧,主要通过硫代磷酸连接。
反义寡核苷酸(ASO)治疗药物通常长度为16-20个核苷酸,由化学修饰的核苷酸组成,位于DNA中央部分的两侧,主要通过硫代磷酸连接。当缺口ASO通过Watson-Crick碱基对与靶RNA序列特异性结合时,中心DNA区域形成DNA/RNA杂交体,引发核糖核酸酶H1切割RNA链。
肺是一个复杂的器官,具有不同的细胞类型,具有不同的作用。反义寡核苷酸(ASO)在肺中已被研究,但由于缺乏适当的分析方法,确定它们在每种细胞类型中的有效性一直是一个挑战。

图片来源: https://doi.org/10.1093/nar/gkac630
近日,来自马萨诸塞大学医学院的研究者们在Nucleic Acids Research杂志上发表了题为“Intratracheally administered LNA gapmer antisense oligonucleotides induce robust gene silencing in mouse lung fibroblasts”的文章,该研究证实了肺成纤维细胞与ASO作为治疗药物有很好的一致性。
在本研究中,研究者采用了三种不同的方法来研究不同细胞类型的沉默效果。首先,研究者使用谱系标记在流式细胞术中鉴定细胞类型,同时检测ASO诱导的细胞表面蛋白CD47或CD98的沉默。
其次,研究者应用单细胞RNA测序(scRNA-seq)来测量不同细胞类型的沉默效果;本研究是第一次应用scRNA-seq来测量寡核苷酸疗法的效果。在这两种方法中,成纤维细胞对局部递送ASOS最敏感,内皮细胞也显著沉默。
第三,研究者通过沉默两个主要在成纤维细胞中表达的靶基因Mfap4和Adam33,证实了成纤维细胞中的强大沉默是广泛适用的。本研究通过独立的方法证明了气管内给药LNA Gapmer ASOS有力地诱导了肺成纤维细胞的基因沉默。ASO诱导的成纤维细胞基因沉默是持久的,在单次给药后持续4-8周。
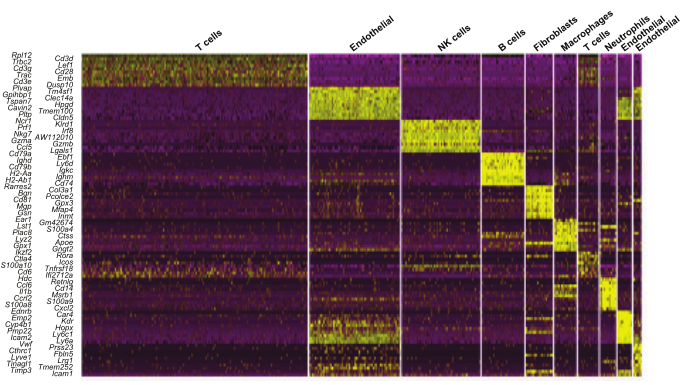
气管内注射靶向MALAT1的LNA裂解物ASO后小鼠肺组织的scRNA-seq分析
图片来源: https://doi.org/10.1093/nar/gkac630
需要进一步的研究来揭示在肺成纤维细胞中观察到的强大的基因沉默背后的机制解释。细胞摄取和细胞内转运共同控制着ASO的生产性摄取。研究发现,影响间质间隙、细胞膜和细胞内ASO活性的蛋白质。
然而,还需要更多的研究来了解ASO的特定细胞类型的行为。除了这里研究的LNA Gapmer ASO外,还需要对其他支架进行系统的研究,包括完全修饰的siRNAs。这些努力有助于理解这些机制,并扩大寡核苷酸疗法的应用。
综上所述,本研究结果表明,通过关注肺成纤维细胞基因表达的调节,开发肺ASO疗法的努力将使其成功的可能性最大化。(生物谷 Bioon.com)
参考文献
Minwook Shin et al. Intratracheally administered LNA gapmer antisense oligonucleotides induce robust gene silencing in mouse lung fibroblasts. Nucleic Acids Res. 2022 Aug 26;50(15):8418-8430. doi: 10.1093/nar/gkac630.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


