Nat Commun:科学家发现驱动胃癌对化疗耐受及肿瘤复发背后的新型分子机制
来源:生物谷原创 2023-08-07 10:44
来自香港大学等机构的科学家们通过研究揭开了一种新型的信号通路,其或能通过RNA编辑来控制脂质代谢从而促进胃癌对化疗的耐受性以及癌症干性特性的产生。
由于缺乏生理学和治疗相关的模型,控制5-氟尿嘧啶和顺铂(5FU + CDDP)耐药性的靶向性驱动因素让研究人员仍然难以捉摸。近日,一篇发表在国际杂志Nature Communications上题为“ADAR1-mediated RNA editing of SCD1 drives drug resistance and self-renewal in gastric cancer”的研究报告中,来自香港大学等机构的科学家们通过研究揭开了一种新型的信号通路,其或能通过RNA编辑来控制脂质代谢从而促进胃癌对化疗的耐受性以及癌症干性特性的产生。
如今,胃癌仍然是香港乃至全球人群因癌症死亡的主要原因,为了对抗胃癌,除了进行外科手术切除外,研究人员还经常会使用5-氟尿嘧啶(5-FU)和基于铂类的联合化疗策略,从而增加手术的有效性从而尽可能减少癌症复发的机会,然而,癌症患者获得性耐药的出现最终会限制患者所获得的长期临床效益。
驱动化疗耐受性的多种机制以及构成胃癌构成的多种疾病亚型常常会模糊克服化疗耐受性靶点的识别,因此,理解亚型特异性的易感性从而来克服癌症对化疗的耐受性是科学家们设计出针对这种致死性癌症的改进型疗法策略的基础。文章中,研究人员发现了一种未被报道的驱动这种化疗耐受性的特殊机制,而通过这种机制,在RNA水平上进行的失调编辑就会引起脂质代谢的异常行为从而赋予癌细胞化疗耐受性以及癌症干性的出现。
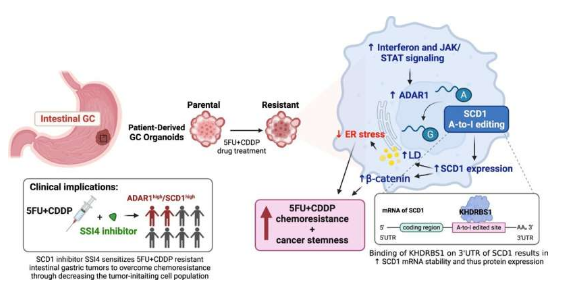
科学家发现驱动胃癌对化疗耐受及肿瘤复发背后的新型分子机制。
图片来源:Nature Communications (2023). DOI:10.1038/s41467-023-38581-8
通过整合临床上胃癌患者衍生的类器官系来模拟5-FU+顺铂耐受性、多组学分析和临床前胃癌小鼠模型进行验证,研究人员发现,对化疗耐受性的列器官或能表现出更大的干扰素和JAK/STAT信号,从而就能上调ADAR1的表达,而ADAR1是一种特殊的酶类,其能指示RNA的编辑,并能通过对参与脂质代谢的多种酶类(包括名为SCD1的关键酶类)进行编辑来促进失调的脂质网络。对SCD1 RNA的编辑或能增强mRNA的稳定性,从而就会增加SCD1蛋白质的表达,因此,SCD1能促进脂滴的形成以及β-连环蛋白的丰度从而赋予其对化疗的耐受性以及更多的癌症干性状态。为了将这一研究结果应用于临床中,研究人员进一步研究后发现,在化疗体系中补充SCD1抑制剂(SSI4)或能逆转胃癌对化疗的耐药性,并减少启动肿瘤的细胞亚群的水平。
研究者Stephanie Ma Kwai-yee教授说道,本文研究我们发现,脂质代谢基因在RNA水平上的编辑失调或许能作为胃癌对化疗耐受性背后的一种新型的分子机制,通过靶向编辑SCD1,我们就能逆转癌症的化疗耐受性和癌症干性特征;这一研究或为后期科学家们开发治疗人类致死性疾病的新型疗法奠定了一定的基础。此外,ADAR1的表达和SCD1或许也能作为良好的生物标志物来帮助预测胃癌患者对化疗的反应,从而就能使得患者免于不必要的化疗并允许其进行更加有效的治疗。综上,本文研究中,研究人员识别出了一种有望帮助规避或克服癌症对化疗产生耐受性的新型潜在靶点。(生物谷Bioon.com)
原始出处:
Wong, TL., Loh, JJ., Lu, S. et al. ADAR1-mediated RNA editing of SCD1 drives drug resistance and self-renewal in gastric cancer. Nat Commun 14, 2861 (2023).doi:10.1038/s41467-023-38581-8
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


