STTT:韩国科学家发现肝癌削弱自然杀伤细胞抗癌能力的新机制!
来源:奇点糕 2025-01-29 09:16
一种在肝细胞癌(HCC)组织中高度表达的跨膜蛋白TM4SF5,通过触发NK细胞刺激性配体SLAMF7的降解,促进HCC发生发展的关键机制。
近期,韩国首尔大学Jung Weon Lee团队与韩国车医科大学(CHA)Young-Ger Suh团队联合发表了一项研究成果。他们揭示了,一种在肝细胞癌(HCC)组织中高度表达的跨膜蛋白TM4SF5,通过触发NK细胞刺激性配体SLAMF7的降解,促进HCC发生发展的关键机制。
具体来说,研究人员发现,TM4SF5会以N-糖基化的方式与SLAMF7结合,诱导其从细胞膜向溶酶体转运并降解。这一过程削弱了SLAMF7对NK细胞活性的刺激作用,抑制了NK细胞对肿瘤的免疫监视功能,从而推动了HCC的发生和发展。
而使用针对TM4SF5的异噁唑小分子抑制剂(TSIs),如ST-5-002,可以有效阻断TM4SF5与SLAMF7的结合,恢复SLAMF7在细胞膜上的表达,进一步增强了NK细胞的活性,并成功抑制了小鼠HCC的进展。
研究发表在Signal Transduction and Targeted Therapy上[1]。

论文首页截图
事实上,既往已有研究显示,TM4SF5作为一种N-糖基化膜蛋白,可以通过抑制NK细胞的活性来促进HCC的进展,但是这背后的机制,以及针对TM4SF5的治疗能否提升NK细胞的活性和对HCC的免疫监视作用,还不清楚。
在本研究中,研究人员先是通过体外实验发现,TM4SF5过表达会降低MICA/B、SLAMF7等NK细胞刺激配体的表达,而TM4SF5敲除则增强了这些配体的水平。接下来的体内分析则显示,在TM4SF5过表达的小鼠肝组织中,NK细胞的活性会出现明显降低(表现为颗粒酶和穿孔素水平的显著降低)。
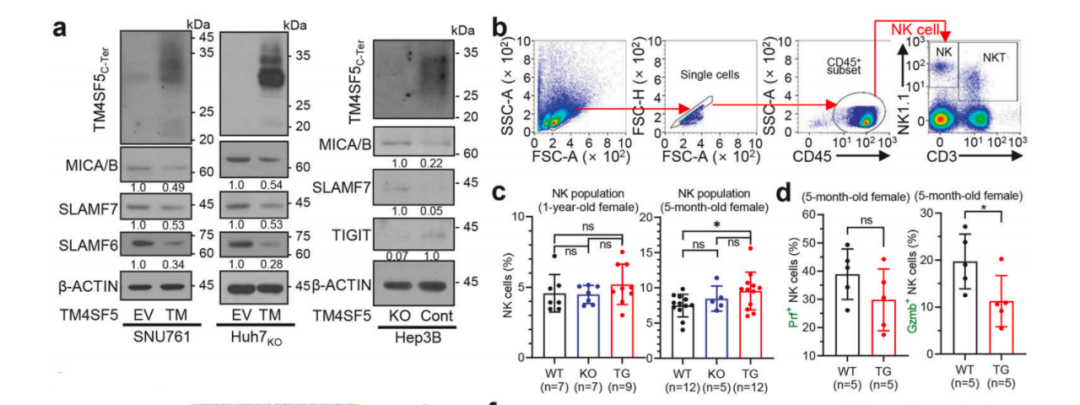
TM4SF5介导NK细胞失活
而进一步的临床数据则发现,高TM4SF5表达和低SLAMF7表达的HCC患者生存率普遍较差,而其他NK细胞配体的表达降低则与患者生存概率无显著关联。以上这些结果表明,TM4SF5主要通过下调NK细胞刺激配体SLAMF7的表达水平,导致NK细胞失活,从而促进HCC的发展。
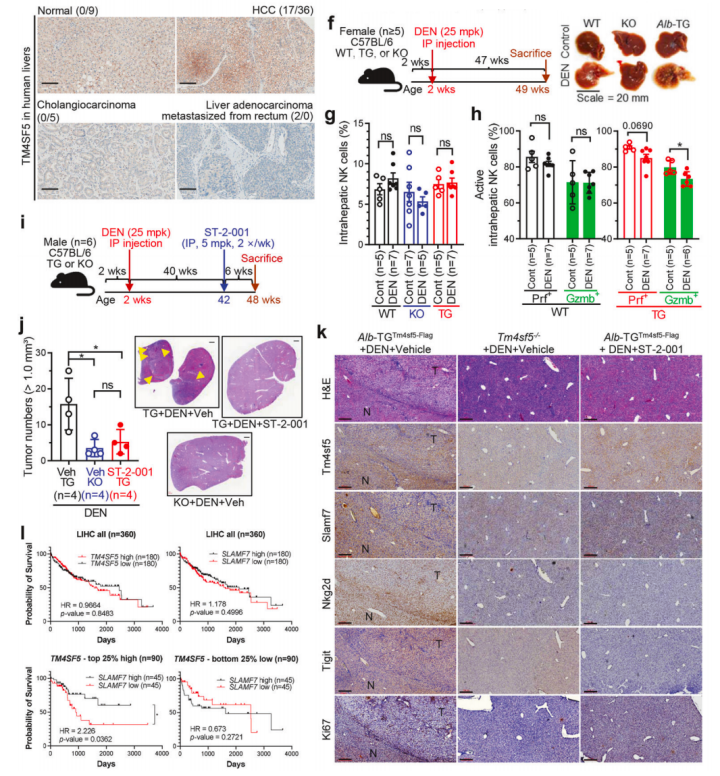
临床分析结果
通过免疫荧光等一系列实验,研究人员发现,机制上,TM4SF5会以依赖N-糖基化的方式与SLAMF7结合,诱导其从细胞膜向溶酶体转运并降解。这一过程削弱了SLAMF7对NK细胞活性的刺激作用,抑制了NK细胞对肿瘤的免疫监视功能,从而推动了HCC的发生和发展。

研究机制图
根据以上机制,研究人员利用综合结构-活性关系分析鉴定出了一类可以特异性与TM4SF5结合的异噁唑结构的小分子抑制剂(TSIs,如ST-2-001、ST-5-002,其中ST-5-002与TM4SF5结合能力更强)。
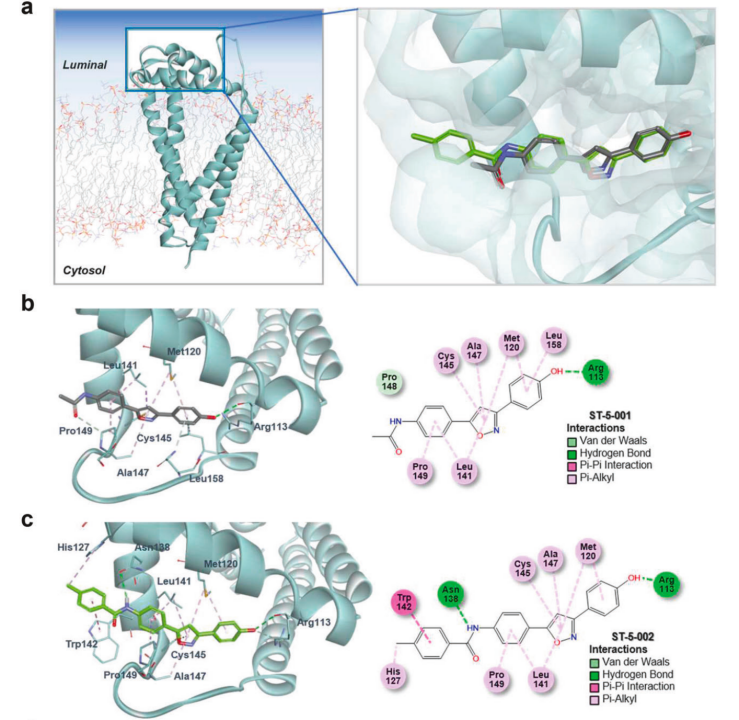
ST-2-001和ST-5-002的结构
结果发现,TSIs可以有效阻断TM4SF5与SLAMF7的结合,恢复SLAMF7在细胞膜上的表达,进一步增强了NK细胞的活性。此外,在TM4SF5阳性患者来源的异种移植(PDX)模型中,研究人员发现,与对照组相比,接受TSIs治疗(腹腔注射,3天一次,共6次)可以显著抑制小鼠HCC的进展。
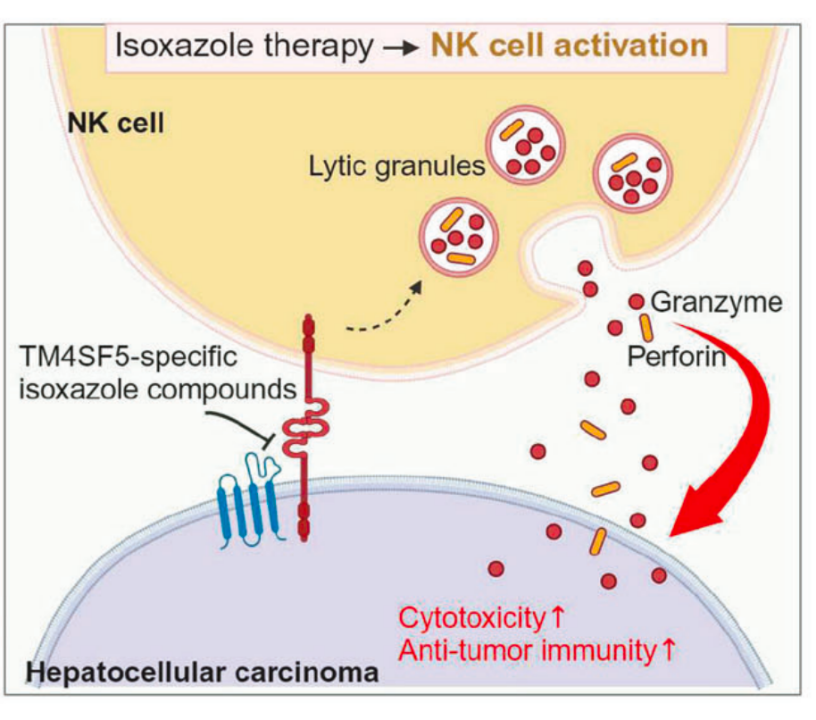
治疗策略图
总之,该研究揭示了TM4SF5通过下调NK细胞刺激配体SLAMF7的表达,削弱NK细胞的免疫监视功能,从而促进HCC进展的机制。而靶向TM4SF5的TSIs则可恢复NK细胞功能,有效抑制HCC进展。
这些发现不仅为TM4SF5-SLAMF7轴作为HCC新型免疫检查点的靶向治疗提供了强有力的支持,也为未来开发创新疗法和优化治疗策略提供了坚实基础。
参考文献:
[1]Kim JE, Kim HS, Kim W, et al. Isoxazole-based molecules restore NK cell immune surveillance in hepatocarcinogenesis by targeting TM4SF5 and SLAMF7 linkage. Signal Transduct Target Ther. 2025;10(1):15. Published 2025 Jan 20. doi:10.1038/s41392-024-02106-6
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


