Nature Cell Biology:胰腺癌鳞状细胞重编程的奥秘
来源:生物探索 2024-10-09 09:41
研究结果显示,ΔNp63(在PASC中表达的TP63亚型,被报道可在癌细胞中促进导管到鳞状的改变)的过表达足以在非PASC肿瘤类器官中诱导出PASC的分子和表型特征。
癌症,是动态进化的,以选择性地在外来肿瘤环境中茁壮成长,例如癌细胞扩散的侵袭性前沿和远端器官。在进化过程中,肿瘤细胞经常重新利用组织固有的发育和致癌程序来获得生存优势,从而偏离其最初的细胞身份【1】。胰腺癌是一种高度恶性的肿瘤,其特点是肿瘤细胞具有显著的分子多样性,可以表现出不同的细胞身份。对胰腺癌的分子分类研究识别出不同的分子亚型,这些亚型与肿瘤的侵袭性、化疗反应和疾病预后有关。
特别是,研究人员发现了两种主要的分子亚型:一种是保留了大量胰腺导管特征的亚型,另一种是预后较差的亚型,这种亚型的特点是失去了导管谱系的特征,并异常激活了基底细胞或鳞状细胞程序。在胰腺癌的发展过程中,肿瘤细胞可能会经历一种称为鳞状转分化的过程,即从导管细胞表型转变为鳞状细胞表型。这种转变与肿瘤的侵袭性和不良预后有关【2,3】。
尽管已经有一些研究关注了这一现象,但关于这一过程的具体分子机制仍然不清楚,而且由于缺乏包含人类胰腺癌分子和组织学谱的实验模型,导管到鳞状谱系转换的生物学相关性和决定因素也尚未确定。
近日,来自日本庆应义塾大学医学院的Toshiro Sato团队在Nature Cell Biology上在线发表题为Wnt-deficient and hypoxic environment orchestrates squamous reprogramming of human pancreatic ductal adenocarcinoma的文章.
深入探讨了人类胰腺导管腺癌在Wnt信号缺乏和缺氧环境下,通过分子多样性和表观遗传变化实现从导管细胞到鳞状细胞的转分化的分子机制,证实H3K27me3介导的表观遗传修饰和TP63基因的激活在这一过程中起到了关键作用,并发现EZH2抑制剂可能对治疗特定类型的胰腺癌具有潜力,不仅展示了不利的肿瘤微环境影响人类胰腺癌在分子层面和组织学层面上的演变的过程,而且为理解人类癌症中细胞谱系转换的原则和重要性提供了洞见,对于理解癌症的复杂性和开发新的治疗方法具有重要意义。

为了全面捕捉人类胰腺癌的分子多样性,本文研究人员构建了65个来自患者的胰腺癌类器官系,使用基于生长因子的选择方法来富集癌症类器官,并分析了这些类器官对Wnt-3A和R-spondin(WR,这是两种在细胞信号传导中起重要作用的分泌型蛋白质,在调节肿瘤微环境中的信号传导中扮演着重要角色,在类器官培养中,Wnt-3A和R-spondin也常被用作培养基质成分,以维持类器官的干细胞特性和促进其增殖)的依赖性,将这些类器官分为三类:需要WR的Wnt非分泌(Wnt−)亚型、利用自分泌Wnt但需要R-Spondin的Wnt分泌(Wnt+)亚型、以及在缺乏WR的情况下能够增殖的WR非依赖(WRi)亚型。与已有研究结果一致,包括WRi亚型在内的胰腺癌类器官大多没有Wnt途径突变,提示非遗传因素在WR非依赖性中起作用。
同时,根据形态特征可以将这些类器官分为3类:具有极化单层形态的囊性类器官,具有多个腔室和偶尔伪分层的筛状类器官,以及显示出密集堆积的层状外观且没有腔室结构的实体类器官。类器官的形态反映了细胞固有的组织学属性,与它们的分子特征和疾病进展阶段有关。特别是实体类器官表现出对WR的非依赖性,这可能反映了疾病晚期的生物学特性。
随后,研究人员利用RNA测序技术对不同类型和状态的胰腺癌类器官进行了全面的基因表达分析,结果显示胰腺癌类器官的整体转录组模式会随着它们对Wnt信号的依赖性不同而发生变化,不依赖Wnt信号的类器官(如WRi亚型)倾向于表达与基底样和鳞状细胞特征相关的基因,如TP63、KRT5和KRT6A。这些TP63高表达的实体类器官的异种移植瘤都显示出与胰腺腺鳞癌(PASC)类似的组织学特征,包括腺体结构的丧失、多边形细胞的片层组织和鳞状细胞标记的表达,被称为PASC类器官。PASC类器官表现出不可逆的实体结构,且大多数不依赖于WR,而且它们还表现出与内胚层和胰腺发育相关的转录因子的低表达,包括GATA6、LGR5(R-spondin受体和典型Wnt信号的靶标),而这可能与它们对Wnt信号的不活跃反应有关。
进一步研究结果显示,ΔNp63(在PASC中表达的TP63亚型,被报道可在癌细胞中促进导管到鳞状的改变)的过表达足以在非PASC肿瘤类器官中诱导出PASC的分子和表型特征。相反,TP63的敲除则导致PASC类器官失去了鳞状细胞属性,恢复了腺体结构,并且对WR的依赖性增加。由此表明TP63是调控人类PASC中鳞状细胞表型的关键分子,并且是PASC发展过程中的一个重要调节因子。
PASC类器官的极端基因表达模式提示在导管到鳞状进展过程中存在广泛的表观基因组重塑,因此通过转座酶可接近的染色质测序(ATAC-seq)和染色质免疫沉淀测序(ChIP-seq),研究人员证实PASC类器官具有独特的染色质可接近性模式,而且H3K27me3修饰在PASC类器官中富集于那些在PASC中表达下调的基因,包括GATA6和LGR5等。由此表明在PASC的发展过程中,表观遗传修饰,特别是H3K27me3的沉积,可能在抑制原始导管细胞身份基因的表达中起到了关键作用,从而促进了向鳞状细胞表型的转换。
进一步地,研究人员探讨了H3K27me3沉积在PASC中的分子基础。实验结果显示,在含有WR的培养条件下,敲除GATA6或KDM6A(一种在鳞状亚型中反复突变或缺失的赖氨酸特异性组蛋白去甲基化酶,可使H3K27去甲基化)的类器官没有表现出明显的形态变化。然而,在缺乏WR的条件下,敲除KDM6A和GATA6的双敲除类器官出现了实体化转变,并且变得不再依赖WR信号,而且表现出了与PASC相似的基因表达模式以及染色质可接近性模式,这些变化也与H3K27me3修饰的重新分布有关。由此表明KDM6A的单独缺失不足以诱导PASC转化,需要GATA6的共同失活和环境WR的耗尽一起发挥作用,促进胰腺癌细胞向鳞状细胞命运的表观遗传重编程,以实现在Wnt缺陷生态位中的选择性生长。与此同时,氧气对于KDM6A的去甲基化活性也至关重要,而且临床胰腺癌肿瘤已知是低血管化的。
研究结果显示,缺氧和Wnt信号缺陷的微环境也可以驱动胰腺癌细胞向鳞状细胞表型的转化,并指导其表观遗传重编程,从而决定PASC的命运。临床数据同样支持了胰腺癌组织的鳞状属性与典型Wnt和氧气利用率低的肿瘤环境之间的关系。单细胞测序结果显示在Wnt缺乏的低氧条件下,从经典导管型到PASC的转换是时间依赖性的,它要通过一个中间状态,而与炎症和应激反应相关的基因在转换过程中被激活,证明从导管谱系到PASC命运的转换特征是导管身份的快速丧失、中间程序的短暂激活和鳞状细胞特征的逐步获得。
最后,研究人员评估了平衡PASC的表观遗传偏倚是否可以对这种致命疾病产生治疗效果。鉴于PRC2和KDM6A在H3K27me3上的相反功能,研究人员检测了EZH2(PRC2的核心组分)抑制对胰腺癌类器官的影响。结果显示,EZH2抑制剂对胰腺癌类器官的生长有明显的抑制作用,尤其是对于那些表现出WR非依赖(WRi)和PASC特征的类器官。此外,对于部分对EZH2抑制剂反应较弱的类器官,通过同时阻断Wnt信号可以增强EZH2抑制剂的效果,提示表观基因组靶向治疗PASC的治疗潜力。
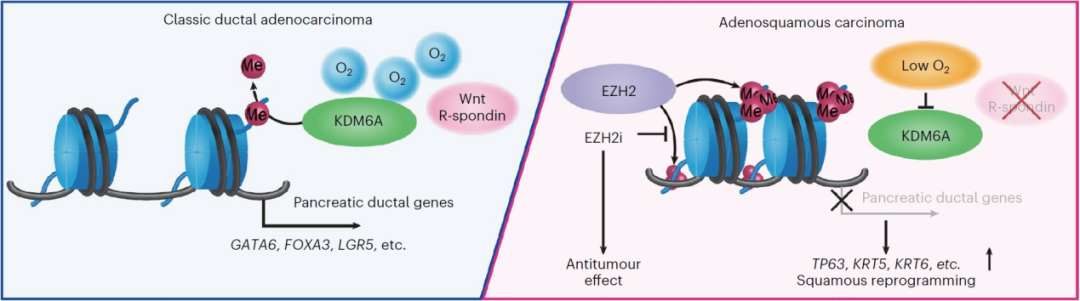
图1 模式图(Credit: Nature Cell Biology)
综上所述,本研究展示了PASC类器官的衍生,随后采用了多层次的方法,整合了基因工程、全面的分子分析和药物测试,揭示了人类胰腺癌中鳞状重编程的分子和环境基础,阐明PASC组织发生的特点在于环境依赖性的表观遗传景观的改变,导致癌细胞导管身份的丧失,而向鳞状细胞谱系的转化,并获得了Wnt信号的非依赖性,而这可能是EZH2抑制的治疗靶点(图1)。由此不仅提供了对人类胰腺癌生物学的基本见解,而且还补充了临床相关PASC模型的缺乏。
1. Fujii, M., Sekine, S. & Sato, T. Decoding the basis of histological variation in human cancer. Nat. Rev. Cancer 24, 141–158 (2024).
2. Collisson, E. A. et al. Subtypes of pancreatic ductal adenocarcinoma and their differing responses to therapy. Nat. Med. 17, 500–503 (2011).
3. Hayashi, A. et al. A unifying paradigm for transcriptional heterogeneity and squamous features in pancreatic ductal adenocarcinoma. Nat. Cancer 1, 59–74 (2020).
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


