外泌体给脂质纳米颗粒“开挂”!ACS Nano:改造后的类外泌体囊泡,组织穿透能力飙升,成药物递送“急先锋”
来源:生物谷原创 2025-03-19 11:29
本研究受外泌体启发,设计含胆固醇、水通道蛋白-1和阴离子脂质的脂质纳米颗粒。结果显示其在模型细胞外基质和生物组织中扩散性能优异,可有效穿透组织,为脂质纳米颗粒设计提供新策略。

在医药领域,药物如何高效抵达作用靶点一直是科研人员努力攻克的难题。想象一下,药物就像治病的“小卫士”,但它们在进入人体后,却常常被细胞外基质(ECM)这道复杂防线拦住去路。ECM是由各种生物分子组成的复杂网络,其结构和成分的异质性,使得传统脂质纳米颗粒难以顺利穿透,导致药物无法均匀分布到组织中,不仅影响治疗效果,还可能增加药物的毒性。
近年来,脂质纳米颗粒作为药物递送载体取得了一些进展,但深入ECM的深层区域仍然困难重重。与之形成鲜明对比的是,细胞分泌的外泌体却能在ECM中自由穿梭,甚至可以抵达远处的器官。外泌体虽具备这样出色的运输能力,可在临床应用时却面临诸多挑战,比如产量低、药物装载困难以及成分存在差异等问题。因此,开发能够模拟外泌体特性的人工系统,成为了科研人员的重要研究方向。
近期,发表于ACS Nano的一项研究Exosome-Inspired Lipid Nanoparticles for Enhanced Tissue Penetration为解决上述难题带来了新的思路。科研团队受到外泌体独特运输现象的启发,设计出了类外泌体囊泡(ELVs)。他们选择了与外泌体运输相关的三种关键成分——胆固醇、水通道蛋白-1(AQP1)和阴离子脂质,将其整合到ELVs中,期望借此提升脂质纳米颗粒在ECM中的穿透能力。


图 1:用于增强细胞外基质(ECM)穿透的类外泌体囊泡(ELV)的设计
研究结果令人眼前一亮。从结构层面来看,胆固醇的加入对ELVs产生了显著影响。当胆固醇融入ELVs的双层膜时,会促使脂质尾部伸展,形成有序液相,进而增加双层膜的厚度。这种厚度的增加使得ELVs的膜刚性增强,有效提高了其在ECM中的胶体稳定性,降低了聚集的风险。
AQP1的作用也不容小觑。它能降低ELVs双层膜的厚度,同时减少囊泡之间的粘附。这是因为AQP1的等电点约为5.0,其携带的负电荷会在囊泡间产生排斥力。研究发现,在不同膜电荷密度下,AQP1的重组均会导致双层膜厚度下降,并且SAXS扫描显示,重组AQP1后ELVs之间的粘附也有所减少。
而阴离子脂质则在减少ELVs与ECM之间的静电捕获方面发挥关键作用。研究表明,当阴离子脂质的含量超过10 mol%时,能够有效防止ELVs在ECM中因电荷作用而发生聚集,保障其在ECM中的顺利扩散。
在优化ELVs成分的研究中,科研人员有了重要发现。含有10 mol%阴离子脂质的ELVs,其相对扩散系数比其他ELVs高出3倍有余。这表明存在一个最佳的阴离子脂质含量,能够平衡ELVs在ECM中的聚集和捕获现象。对于胆固醇含量的研究发现,25 mol%胆固醇的ELVs相对扩散系数比50 mol%的更高。然而,当引入AQP1后,情况发生了变化,含有50 mol%胆固醇且有AQP1的ELVs,其扩散系数比含有25 mol%胆固醇的ELVs高出1.8倍。这充分说明,50 mol%胆固醇与AQP1的组合,在稳定性和扩散性能方面表现更为优异。此外,研究还发现,在较软的ECM环境中,ELVs的相对扩散系数较低,但AQP1的存在能使其提升76%,进一步证明了AQP1对于ELVs扩散的重要性。
单粒子追踪实验结果显示,无论是在软模型ECM还是硬模型ECM中,ELVs的扩散能力都远远超过传统脂质体(LIP)。在生物组织实验中,研究人员选取了肌肉、软骨和白膜这三种具有不同ECM密度的组织进行研究。结果表明,ELVs在这些组织中的有效扩散系数均显著高于LIP。以肌肉组织为例,ELVs的有效扩散系数比LIP高出77.8%。
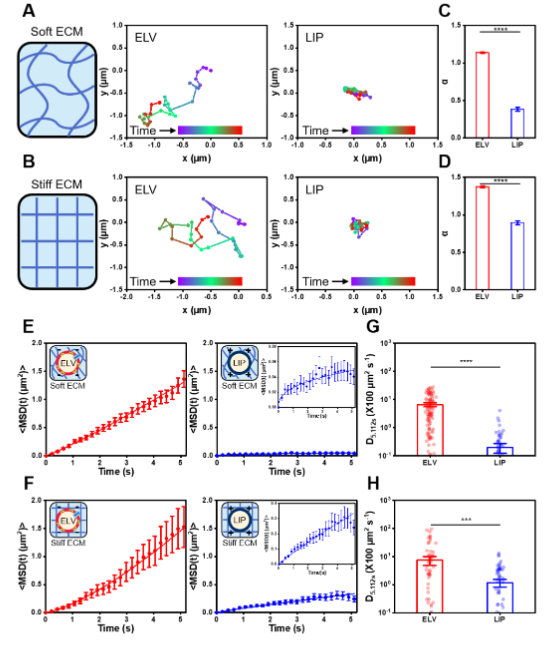
图 2:模型组织内ELV的单粒子追踪
在体内评估实验中,科研人员将ELVs应用于乳腺癌小鼠模型。瘤内注射3小时后,大部分LIPs仍停留在注射部位,而ELVs却能够均匀地分布在整个肿瘤组织中。科研人员还将化疗药物阿霉素封装到ELVs中(DOX@ELVs),静脉注射到小鼠体内后发现,DOX@ELVs能在1小时内大量聚集在肿瘤组织,并持续停留9小时,有效抑制了肿瘤的生长。
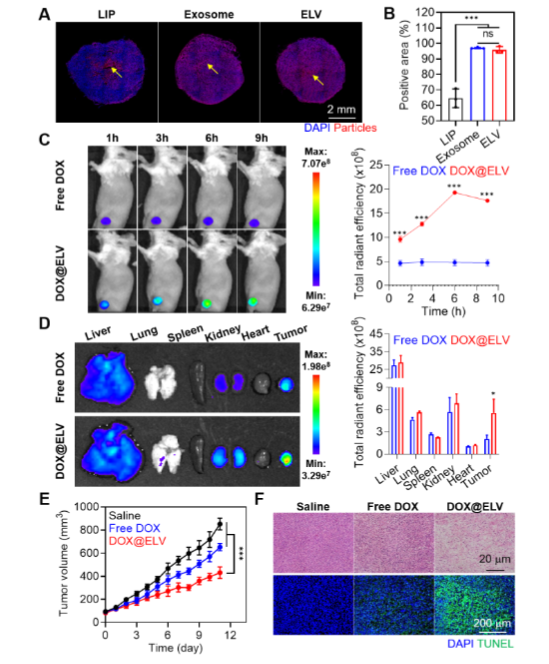
图 3:乳腺癌动物模型中的组织穿透和药物递送
这项研究通过模拟外泌体设计出ELVs,并深入探究了各成分对其结构和性能的影响。优化后的ELVs在多种环境下都展现出了卓越的组织穿透能力和药物递送潜力。这一成果为脂质纳米颗粒的设计提供了全新的方向,有望在未来的医药领域,尤其是药物递送和疾病治疗方面发挥重要作用,为广大患者带来新的希望。(生物谷Bioon.com)
参考文献:
Bang S, Park B, Park JC, et al. Exosome-Inspired Lipid Nanoparticles for Enhanced Tissue Penetration. ACS Nano. Published online February 28, 2025. doi:10.1021/acsnano.4c16629
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


