Cell:李晓明/张岩团队破译大麻素受体选择性信号转导机制
来源:生物世界 2023-12-15 16:36
Cell 评审专家认为,这项研究对于理解CB1受体配体偏向信号传递机制迈出了重要的一步,为发现新颖的偏向性CB1小分子奠定了坚实的基础,在以CB1为靶点的药物开发中具有重要意义。
浙江大学医学院李晓明教授课题组联合张岩教授课题组合作,在国际顶尖学术期刊 Cell 上发表了题为:Snapshot of the cannabinoid receptor 1-arrestin complex unravels the biased signaling mechanism 的研究论文。
该研究成功从原子分辨率水平解析了大麻素受体CB1的β-arrestin1信号转导复合物的精细三维结构,结合细胞水平功能分析发现了大麻素受体CB1介导β-arrestin信号的关键结构决定因素,阐明了大麻素受体CB1产生下游特定信号谱图的机制,为推动开发精细调控大麻素受体CB1功能信号的合成大麻素奠定基础,从而在保留大麻治疗效果的同时规避其副作用。


亟待完善的“拼图”
李晓明教授团队长期研究焦虑障碍、抑郁症、疼痛以及创伤性应激障碍等神经精神疾病的发病机制,致力于发现诊治新靶点并提供相应的治疗策略。研究团队前期研究发现了大麻素受体CB1在杏仁核胆囊收缩素神经元介导的神经环路中调控负性情绪和抑郁,外源性给予大麻通过大麻素受体CB1可以对抗抑郁(Nature Medicine 2019);进一步,该团队在成年绒猴中敲低了杏仁核中的CB1,绒猴出现了焦虑样表型(Neuroscience Bulletin 2023);此外,他们还发现了CB1调控疼痛阈值的神经环路,阐明了大麻镇痛的新机制(Neuron 2020)。这些研究不仅阐明了大麻治疗神经精神疾病的神经机制,还为相关疾病的诊断和治疗提供了新的靶点。
然而,近几十年来,靶向大麻素受体CB1的小分子药物开发面临着巨大的挑战,包括药物滥用的风险以及副作用的控制。大麻素受体CB1属于G蛋白偶联受体(GPCR),通过激活下游Gi/o和β-arrestin(阻遏素)这两类信号来发挥功能。目前研究认为,在以GPCR为靶点的药物开发中,可以通过操控受体选择激活下游特定的G蛋白信号通路或arrestin信号通路,引发不同的细胞级联响应,将治疗作用与副作用分离,从而开发更安全且副作用更小的药物。因此,获得CB1–β-arrestin信号转导复合物结构并阐明选择性机制将是完善大麻素受体CB1成药的一块关键“拼图”。
而要完成“拼图”,则需要“火眼金睛”和“金刚钻”。张岩教授团队长期致力于细胞跨膜信号转导的机制研究和精准调控手段设计,特别是围绕参与重大疾病的GPCR信号转导调控机制取得重大进展,发展并奠定了基于冷冻电镜的GPCR药理学研究方法,国际首次获得了GPCR信号转导复合物的高分辨率冷冻电镜三维结构,从原子层面解析生命接收信息、处理信息和编译信息的过程,探索影响疾病发生发展和参与疾病调控的重要蛋白质机器的内在机制,为发现创新药靶和调控新机制提供了理论依据,在基于结构设计精细调控GPCR功能的先导分子并实现疾病的精准干预方面取得了系列创新成果。
偏向激活的“开关”
触发大麻素受体CB1下游不同信号通路的“开关”究竟是什么?
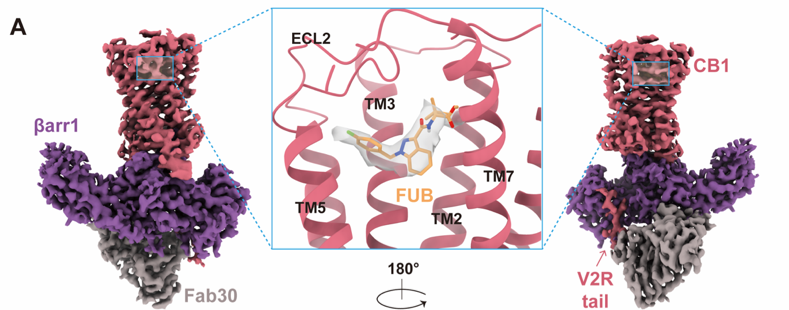
大麻素受体CB1–β-arrestin1冷冻电镜结构
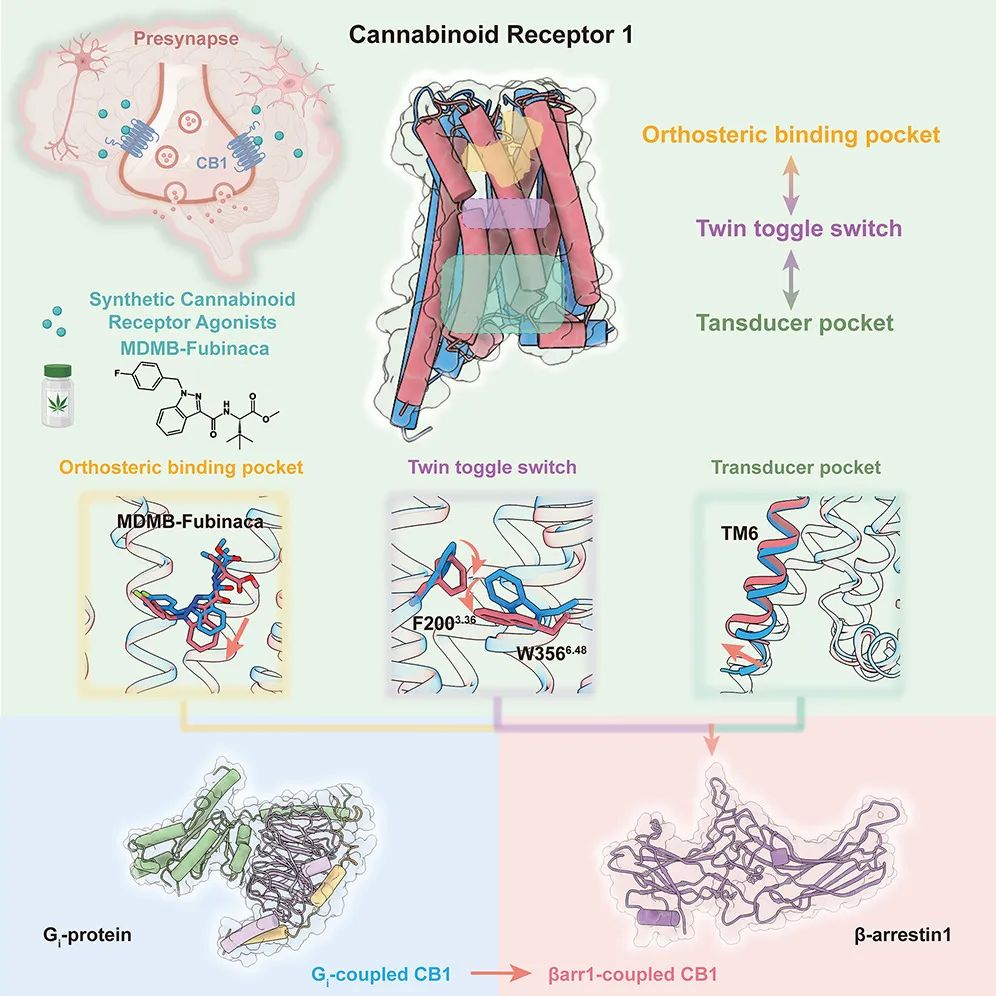
团队进一步研究揭示,大麻素受体CB1的配体口袋与下游不同信号分子口袋的偏向性信号的转导路径。双拨动开关的额外向下打开为配体提供了额外向下插入的空间,同时,配体侧链的灵活变动维持了其向下插入的构象,从而稳定了“双拨动开关”向下的偏转,引发CB1招募β-arrestin,表明了正构口袋和下游信号分子口袋之间的变构相关性。
张岩教授表示,如果把大麻素受体CB1比作一扇上锁的门,配体比作钥匙,那么CB1–β-arrestin结构则揭示了打开不同通路的锁芯构造的差异,从而获得钥匙形状特征,准确设计出开启下游不同信号通路的偏向性合成大麻素,这解决了以往需要大量人力物力进行药物筛选的问题。如果能阻碍配体侧链的灵活转动,则可设计出G蛋白偏向性的合成大麻素;如果能帮助配体插入正构口袋的深处,则可设计出β-arrestin偏向性的合成大麻素。
李晓明教授表示,目前,医用大麻用于神经精神疾病的临床治疗因为副作用仍有很长一段路要走。但是我们的研究为高效、精准设计更优的“钥匙”奠定了夯实的基础。我们目前已经成功设计了偏向性的合成大麻素,正在开展相关的动物实验研究。
Cell 评审专家认为,这项研究对于理解CB1受体配体偏向信号传递机制迈出了重要的一步,为发现新颖的偏向性CB1小分子奠定了坚实的基础,在以CB1为靶点的药物开发中具有重要意义。
浙江大学李晓明教授和张岩教授为该论文共同通讯作者。浙江大学博士生廖宇莹、博士后张会冰、特聘副研究员沈庆亚和博士生蔡晨曦为论文共同第一作者。此外,博士生丁宇、沈丹丹、郭嘉、秦娇和董映君也在其中做出了重要贡献。本研究得到国家自然科学基金、国家科技部科技创新2030—“脑科学与类脑研究”重大项目等资助。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


