2022年这4款抗肿瘤新药上市,深刻改变了临床实践
来源:医药魔方 2022-12-23 16:40
2022年,全球的肿瘤研究者和制药企业在疫情的笼罩之下艰难前行。从获批情况看,2022年全球新药获批方案有所放缓。尽管如此,其中不乏一些亮点新药方案的出现,给肿瘤学领域带来了希望。
2022年,全球的肿瘤研究者和制药企业在疫情的笼罩之下艰难前行。从获批情况看,2022年全球新药获批方案有所放缓。尽管如此,其中不乏一些亮点新药方案的出现,给肿瘤学领域带来了希望。今天,医药魔方DeepMed数据库在今年全球获批的新药中,挑选了4个重点药物进行深度剖析,看看这些“希望之星”有哪些特别之处,未来将如何改变临床实践。
替西木单抗是继伊匹木单抗之后的全球第二款上市的抗CTLA-4单抗。今年10月21日和11月10日,FDA批准了替西木单抗两项一线治疗适应症:联合度伐利尤单抗一线治疗不可切除肝细胞癌;联合度伐利尤单抗和含铂化疗一线治疗EGFR、ALK阴性的转移性非小细胞肺癌。
获批证据:替西木单抗获批肝细胞癌适应症是基于HIMALAYA III期试验【1】的数据,共纳入了1171既往未接受全身治疗且不适合接受局部疗法的肝细胞癌患者。研究的主要终点为替西木单抗联合度伐利尤单抗(STRIDE方案)疗法对比索拉非尼的总生存期(OS)。
结果显示,相较于索拉非尼单药,STRIDE方案的OS得到显著改善(mOS:16.4 vs 13.8个月;p=0.0035),死亡风险降低22%。STRIDE方案的成功,也是第一次将双免组合推进到晚期HCC的一线治疗领域,取得了突破性的进展。
 图:HIMALAYA研究主要结果(来源:医药魔方DeepMed数据库)
图:HIMALAYA研究主要结果(来源:医药魔方DeepMed数据库)
替西木单抗联合度伐利尤单抗是肝细胞癌一线治疗首个双免疫疗法。在此之前获批的纳武利尤单抗+伊匹木单抗也只是作为二线疗法。目前CSCO指南已经将该方案纳入晚期肝细胞癌的一线治疗。NCCN指南也于2022年12月9日更新了肝细胞癌第四版,晚期肝细胞癌的一线治疗的首选方案中增加了替西木单抗+度伐利尤单抗,作为1类证据。
除肝癌外,替西木单抗+度伐利尤单抗方案也在非小细胞肺癌领域迎来了突破。2022年11月发表于JCO的POSEIDON研究显示:对于EGFR/ALK阴性IV期非小细胞肺癌患者,度伐利尤单抗联合替西木单抗联合化疗于单纯化疗相比,显著延长PFS和OS(中位PFS:6.2 vs 4.8个月;中位OS:14.0 vs 11.7个月),且耐受性良好【2】。2022年11月10日,FDA批准了该方案,成为继纳武利尤单抗联合伊匹木单抗之后的第2款PD-1联合CTLA-4抑制剂一线治疗NSCLC的联合疗法。相应推荐也新增在NCCN2022 V6版非小细胞肺癌指南中。
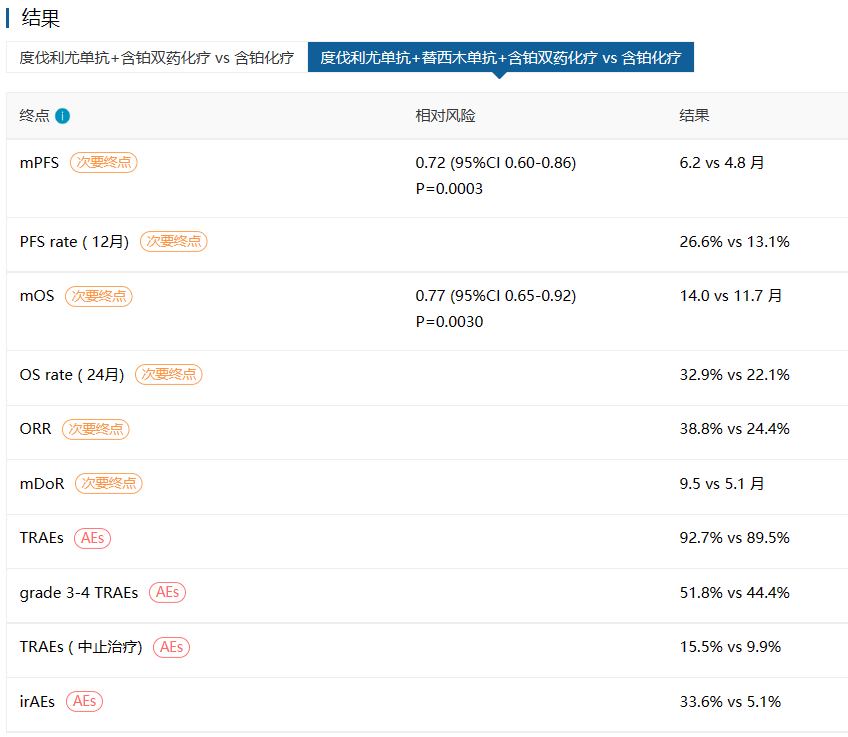 图:POSEIDON研究主要结果(来源:医药魔方DeepMed数据库)
图:POSEIDON研究主要结果(来源:医药魔方DeepMed数据库)
魔方点评:CTLA-4是第一个被发现的免疫检查点,但一直仅有伊匹木单抗获批上市,直到今年替西木单抗获批。而替西木单抗其实是与伊匹木单抗几乎同期上临床的,前后却经历18年无比艰难的开发历程。
早在2004年,辉瑞便将替西木单抗投入到临床试验中,虽然I、II期研究表明可诱导转移性黑色素瘤患者产生持久的反应,但III期试验中期数据显示其疗法并不优于标准化疗,宣告失败。2008年,辉瑞停止了替西木单抗治疗晚期黑素瘤的临床试验。2011年,阿斯利康获得了辉瑞的授权。2013年,III期临床研究黑素瘤(NCT00257205)失败,而就在同年,伊匹木单抗获得FDA批准上市。
2015年,FDA授予替西木单抗治疗恶性间皮瘤孤儿药地位。2017年,III期临床研究MYSTIC(非小细胞肺癌)失败;2019年,III期研究NEPTUNE(非小细胞肺癌)宣告失败。2020年2月,FDA授予其治疗肝细胞癌的孤儿药资格。2020年3月,III期研究DANUBE(膀胱癌)宣告失败。2020年,III期EAGLE(头颈部鳞状细胞癌)失败。直到今年,替西木单抗才终于获得了FDA批准。
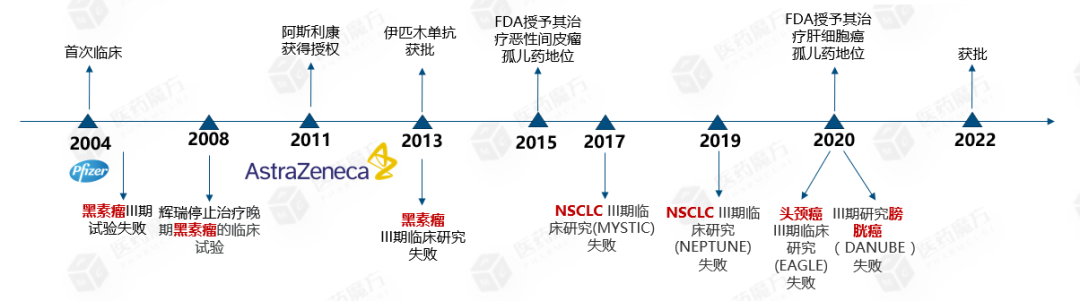 图:替西木单抗临床研发历程(来源:医药魔方NextPharma数据库)
目前,替西木单抗正在进行的III期核心临床试验有5项,方案均与度伐利尤单抗联用,所涉及到的适应症领域有肝细胞癌、膀胱癌、尿路上皮癌、肺癌和肾癌。
替西木单抗开发困难的原因也与CTLA-4靶点的作用机制有关。相比于PD-1靶点,CTLA-4更为复杂。经典的CTLA-4抗体是阻断CTLA-4与B7配体间的相互作用,从而激活免疫细胞。但是,这个机制近年来也出现了争议。
有研究者认为,抗CTLA-4抗体可能是通过ADCP和ADCC效应来选择性的清除肿瘤细胞中的调节性T细胞(Treg)来发挥疗效的,也就意味着,伊匹木单抗不仅可在淋巴结内解除CTLA-4靶点的免疫刹车作用,在肿瘤微环境中还可能通过Fc段介导的ADCC效应去杀死调节性T细胞。但对于替西木单抗来讲,其为IgG2型抗体,理论上具有较弱的ADCC作用,不具有或者具有很微弱的清除调节性T细胞的作用,但替西木单抗依旧在联用中取得了优异的阳性结果,这也提示着CTLA-4研发的又一思路。
现如今,纵观CTLA-4单抗的研发现状,II/III期进行中的临床共有七款。主要还依旧是IgG1类型的抗CTLA抗体。
表:目前正在进行II/III期临床试验的CTLA-4单抗(来源:医药魔方NextPharma数据库)
图:替西木单抗临床研发历程(来源:医药魔方NextPharma数据库)
目前,替西木单抗正在进行的III期核心临床试验有5项,方案均与度伐利尤单抗联用,所涉及到的适应症领域有肝细胞癌、膀胱癌、尿路上皮癌、肺癌和肾癌。
替西木单抗开发困难的原因也与CTLA-4靶点的作用机制有关。相比于PD-1靶点,CTLA-4更为复杂。经典的CTLA-4抗体是阻断CTLA-4与B7配体间的相互作用,从而激活免疫细胞。但是,这个机制近年来也出现了争议。
有研究者认为,抗CTLA-4抗体可能是通过ADCP和ADCC效应来选择性的清除肿瘤细胞中的调节性T细胞(Treg)来发挥疗效的,也就意味着,伊匹木单抗不仅可在淋巴结内解除CTLA-4靶点的免疫刹车作用,在肿瘤微环境中还可能通过Fc段介导的ADCC效应去杀死调节性T细胞。但对于替西木单抗来讲,其为IgG2型抗体,理论上具有较弱的ADCC作用,不具有或者具有很微弱的清除调节性T细胞的作用,但替西木单抗依旧在联用中取得了优异的阳性结果,这也提示着CTLA-4研发的又一思路。
现如今,纵观CTLA-4单抗的研发现状,II/III期进行中的临床共有七款。主要还依旧是IgG1类型的抗CTLA抗体。
表:目前正在进行II/III期临床试验的CTLA-4单抗(来源:医药魔方NextPharma数据库)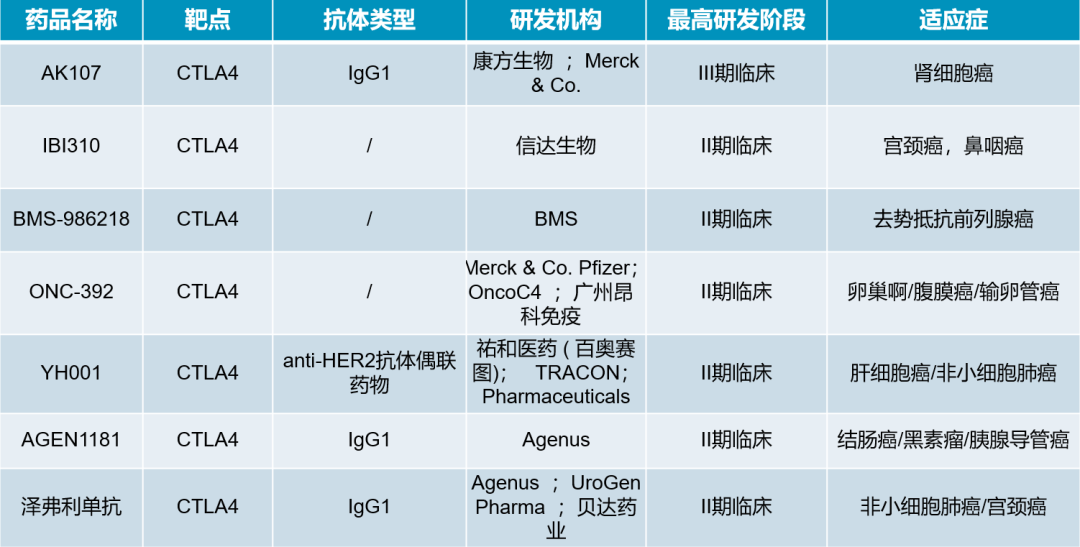 除了双免疗法,双抗药物也在肿瘤领域积攒了很高的热度。PD-1/CTLA-4双抗进度最快的就是康方生物的卡度尼利单抗(AK104),该双抗是依托于康方自主研发的技术平台,最终形成了一个人源化四聚体双特异性抗体。2022年,我国批准卡度尼利单抗用于经铂类治疗失败的复发或转移性宫颈癌,成为全球首个获批上市的PD-1/CTLA-4双抗。
KN046是一款康宁杰瑞自主研发CTLA-4和PD-L1单域抗体融合而成的国产双抗,其可靶向富集于PD-L1高表达的肿瘤微环境并清除Treg细胞。在多个适应症的II/III期临床试验中取得了积极的结果,且都为一、二线治疗。
值得注意的是KN046在晚期胰腺癌中的出色表现。KN046-IST-04是一项评估KN046联合吉西他滨+紫杉醇白蛋白(AG)方案一线治疗晚期胰腺癌的II期研究,结果显示ORR值达到了50%。ENREACH-PDAC-01是一项正在进行的一线治疗晚期胰腺癌III期临床试验,试验组是KN046联合AG,对照组为安慰剂+AG,今年2月首例患者入组,预计明年会有中期结果的报告。
除了双免疗法,双抗药物也在肿瘤领域积攒了很高的热度。PD-1/CTLA-4双抗进度最快的就是康方生物的卡度尼利单抗(AK104),该双抗是依托于康方自主研发的技术平台,最终形成了一个人源化四聚体双特异性抗体。2022年,我国批准卡度尼利单抗用于经铂类治疗失败的复发或转移性宫颈癌,成为全球首个获批上市的PD-1/CTLA-4双抗。
KN046是一款康宁杰瑞自主研发CTLA-4和PD-L1单域抗体融合而成的国产双抗,其可靶向富集于PD-L1高表达的肿瘤微环境并清除Treg细胞。在多个适应症的II/III期临床试验中取得了积极的结果,且都为一、二线治疗。
值得注意的是KN046在晚期胰腺癌中的出色表现。KN046-IST-04是一项评估KN046联合吉西他滨+紫杉醇白蛋白(AG)方案一线治疗晚期胰腺癌的II期研究,结果显示ORR值达到了50%。ENREACH-PDAC-01是一项正在进行的一线治疗晚期胰腺癌III期临床试验,试验组是KN046联合AG,对照组为安慰剂+AG,今年2月首例患者入组,预计明年会有中期结果的报告。
德曲妥珠单抗(DS8201、T-Dxd):3大适应症获批,开创低表达HER2乳腺癌新格局
DS8201是继恩美曲妥珠单抗之后的全球第二款获批抗HER2 ADC药物,多次获得FDA授予的突破性疗法认证。今年共获批了3个适应症:
2022年5月4日,FDA批准DS8201用于既往经历过至少1次抗HER2治疗的不可切除或转移性HER2阳性乳腺癌患者;
2022年8月5日,FDA批准DS8201用于经过化疗或辅助化疗6个月内疾病复发的HER2低表达(IHC1+或IHC2+/ISH-)乳腺癌患者;
2022年8月11日,FDA批准DS8201用于既往接受过一种系统疗法的HER2突变不可切除或转移性非小细胞肺癌患者。
获批证据:基于关键3期试验DESTINY-Breast 03(NCT03529110)结果【3】,DS8201获批既往接受过抗HER2疗法的不可切除或转移性HER2+乳腺癌患者。DB-03是一项与恩美曲妥珠单抗头多头的临床试验。在中期分析报告中,相较于恩美曲妥珠单抗,DS8201将1年疾病进展或死亡风险降低72%。
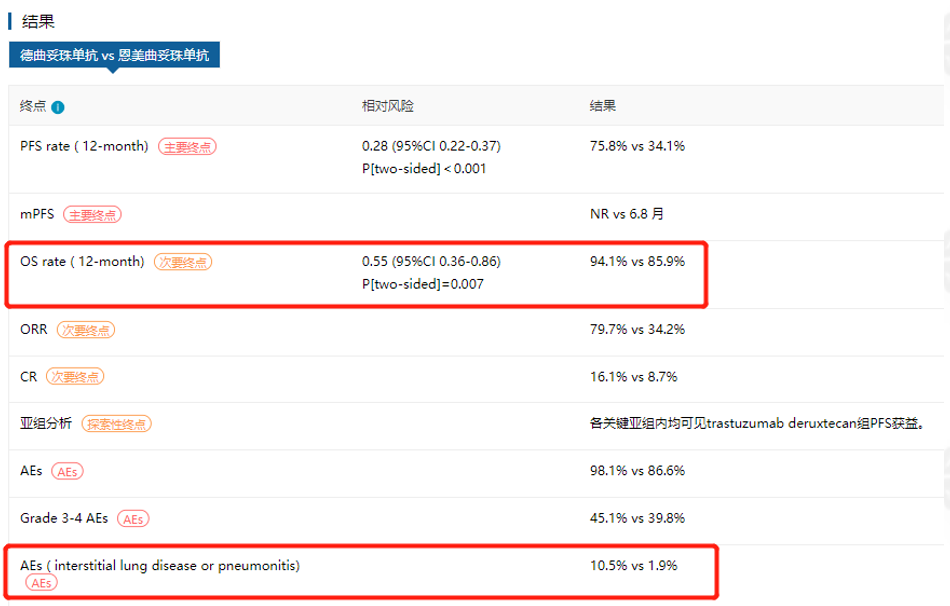 图:DESTINY-Breast 03研究主要结果(来源:医药魔方DeepMed数据库)
但是值得注意的是,DS8201的获批也伴随着FDA的黑框警告,存在间质性肺病和胚胎/胎儿毒性。前不久(12月8日),阿斯利康公布了DESTINY-Breast03的最新结果,DS8201组和恩美组中位随访时间分别为28.4个月和26.5个月,主要终点PFS中,与恩美相比,DS8201可降低疾病进展或死亡风险67%。
除了以上适应症,DS8201备受瞩目的还有在HER2低表达乳腺癌领域取得的突破性进展。此次获批是基于DESTINY-Breast04的结果,这是首个治疗HER2低表达转移性乳腺癌的III期研究。在今年的ASCO大会上公布了这项研究的结果。在HR+患者中,DS8201治疗组中位PFS相较于TPC治疗延长4.7个月(10.1 vs 5.4个月),疾病进展或死亡风险显著降低49%(HR 0.51,95% CI:0.40~0.64,p<0.0001)【4】。
图:DESTINY-Breast 03研究主要结果(来源:医药魔方DeepMed数据库)
但是值得注意的是,DS8201的获批也伴随着FDA的黑框警告,存在间质性肺病和胚胎/胎儿毒性。前不久(12月8日),阿斯利康公布了DESTINY-Breast03的最新结果,DS8201组和恩美组中位随访时间分别为28.4个月和26.5个月,主要终点PFS中,与恩美相比,DS8201可降低疾病进展或死亡风险67%。
除了以上适应症,DS8201备受瞩目的还有在HER2低表达乳腺癌领域取得的突破性进展。此次获批是基于DESTINY-Breast04的结果,这是首个治疗HER2低表达转移性乳腺癌的III期研究。在今年的ASCO大会上公布了这项研究的结果。在HR+患者中,DS8201治疗组中位PFS相较于TPC治疗延长4.7个月(10.1 vs 5.4个月),疾病进展或死亡风险显著降低49%(HR 0.51,95% CI:0.40~0.64,p<0.0001)【4】。
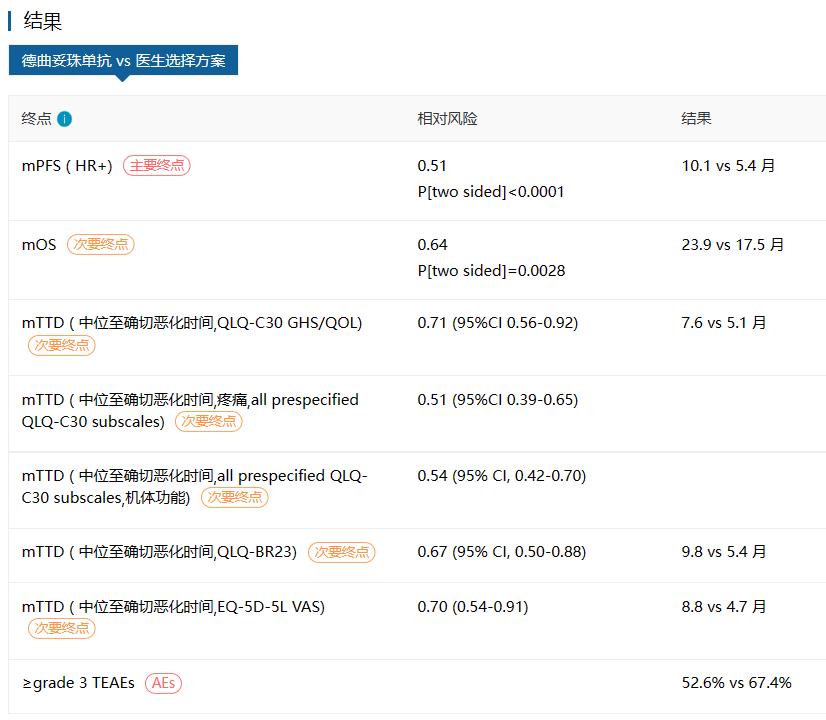 图:DESTINY-Breast 04研究主要结果(来源:医药魔方DeepMed数据库)
图:DESTINY-Breast 04研究主要结果(来源:医药魔方DeepMed数据库)
DS8201是肺癌领域首个HER2靶向药物,获批用于既往接受过一种系统疗法HER2突变的不可切除或转移性NSCLC患者。此项获批是基于II期试验DESTINY-Lung02(NCT04644237)结果,ORR达到53.8%【5】。这项获批也开启了ADC药物在肺癌领域的新纪元。
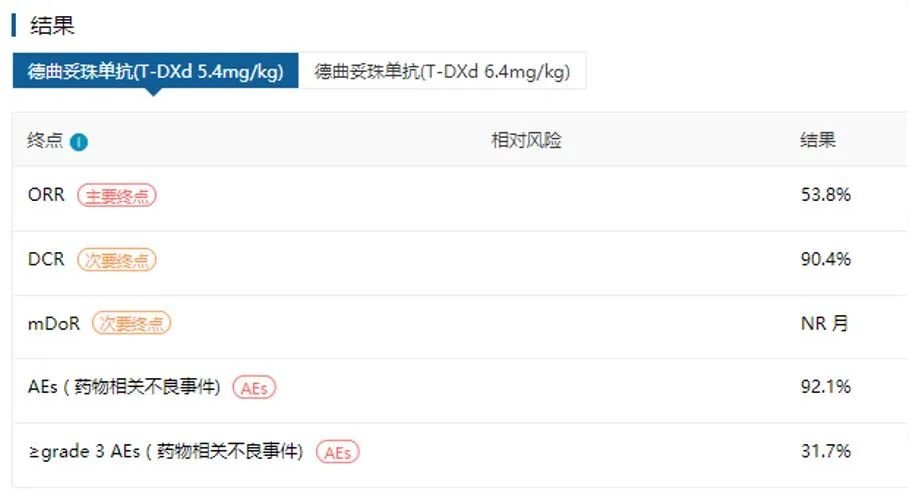 图:DESTINY-Lung02研究主要结果(来源:医药魔方DeepMed数据库)
图:DESTINY-Lung02研究主要结果(来源:医药魔方DeepMed数据库)
魔方点评:DS8201自上市以来就一路披荆斩棘,在胃食管交界处癌,胃癌,乳腺癌,肺癌等领域取得了非常不错的成果,短短3年里在美国、欧洲、日本等地一共获批了12个细分适应症。同时,目前全球范围内,在研II/III期临床试验占比接近70%。
 图:德曲妥珠单抗获批适应症情况(来源:医药魔方NextPharma数据库)
图:德曲妥珠单抗获批适应症情况(来源:医药魔方NextPharma数据库)
今年DS8201最大的“彩蛋”莫过于DB-04研究结果出炉,这也确立了DS8201作为HER2低表达转移性乳腺癌新的治疗新标准。除了DB-04研究,在今年圣安东尼奥乳腺癌研讨会上,DS8201的II期TALENT研究的首个分析结果也重磅发布。
TALENT研究是DS8201在HR+/HER2低表达早期乳腺癌新辅助治疗的首次探索。患者以1:1的比例随机分配至DS8201单药治疗组(A组)和DS8201+阿那曲唑治疗组(B组)。研究的主要终点为患者手术时的pCR率。
意向性分析结果显示,A组ORR为68%,其中2例为CR,15例为PR;B组ORR为58%,2例为CR,14例为PR。其结果显示,DS8201作为新辅助治疗,在HER2低表达、HR阳性的早期局限性乳腺癌患者中显示出良好的疗效,并表现出良好的安全性特征,其疗效似乎不受添加内分泌治疗的影响。
为何DS8201能够在HER2低表达人群中获得如此优异的结果?从机制上来看,这与DS8201优异的旁观者效应息息相关。德曲妥珠单抗与HER2受体形成复合物进入肿瘤细胞内,在溶酶体酶的作用下被裂解并释放出新型拓扑异构酶I型抑制剂 (DXd)。DXd独特的化学性质,使其具有良好的细胞膜渗透性,能渗透并杀伤旁邻肿瘤细胞,即产生旁观者效应。并且,DS8201的药物/抗体比率值高达8,即一个曲妥珠单抗分子可以同时偶联8个DXd,这些特性有助于DS8201针对HER2低表达患者也能发挥强效的抗肿瘤作用。
除HER2低表达人群之外,在今年的圣安东尼奥乳腺癌研讨会(SABCS)上,Ⅲ期DESTINY-Breast02研究(NCT03523585)结果公布:在既往接受恩美曲妥珠单抗(T-DM1)治疗的HER2阳性晚期乳腺癌患者中,与医生选择的治疗(TPC)相比,DS8201在晚期HER2阳性不可切除和/或转移性乳腺癌患者中的疾病进展或死亡风险下降约65%。
目前除了已上市的DS8201,HER2低表达乳腺癌的临床在研药物如下表中所示,包括正在进行III期试验的曲妥珠单抗、维迪西妥单抗和一个癌症疫苗,以及两个II期临床药物和两个I期临床试验的药物。
表:目前HER2低表达乳腺癌在研药物(来源:医药魔方NextPharma及DeepMed数据库)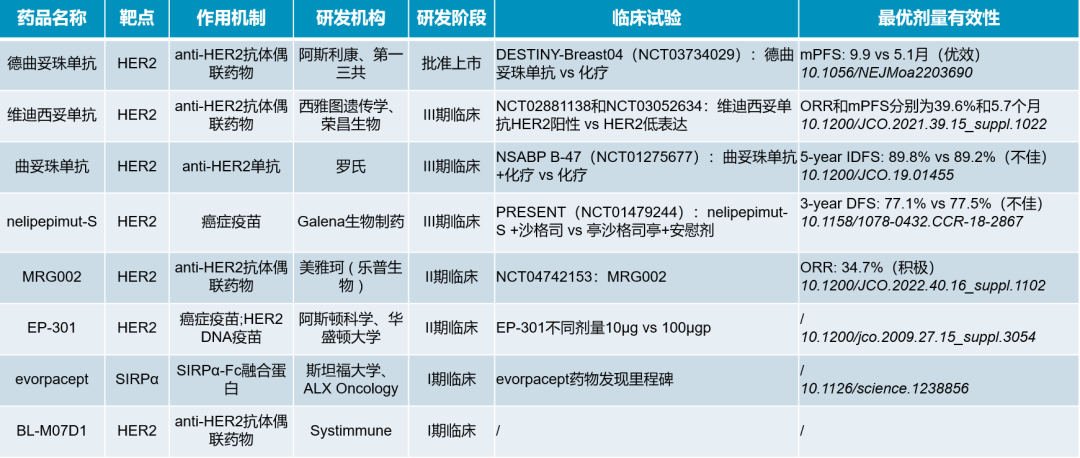 Opdualag:首个抗LAG-3/PD-1免疫复方制剂上市
Opdualag是LAG-3靶向药物瑞拉利单抗与PD-1靶向药物纳武利尤单抗所制成的固定剂量复合剂,是首款获批的抗LAG-3产品,也是first-in-class的双免联合产品。2022年3月18日,FDA批准Opdualag用于治疗不可切除或转移性黑色素瘤成人或大于12岁儿童患者。
获批证据:RELATIVITY-047研究是一项II/III期双盲、随机、对照、多中心临床试验,主要针对先前未治疗的不可切除或转移性黑色素瘤患者,对比纳武利尤单抗联合瑞拉利单抗与纳武利尤单抗单药的治疗【6】。
可以看到,纳武利尤单抗联合瑞拉利单抗相较于对照组,显著延长PFS(中位:10.1 vs 4.6个月),降低了25%的疾病进展或死亡风险(HR 0.75,P=0.006)。在不良事件方面,3-4级治疗相关不良事件有较为明显的提升,但整体不良反应均在可接受范围内。
Opdualag:首个抗LAG-3/PD-1免疫复方制剂上市
Opdualag是LAG-3靶向药物瑞拉利单抗与PD-1靶向药物纳武利尤单抗所制成的固定剂量复合剂,是首款获批的抗LAG-3产品,也是first-in-class的双免联合产品。2022年3月18日,FDA批准Opdualag用于治疗不可切除或转移性黑色素瘤成人或大于12岁儿童患者。
获批证据:RELATIVITY-047研究是一项II/III期双盲、随机、对照、多中心临床试验,主要针对先前未治疗的不可切除或转移性黑色素瘤患者,对比纳武利尤单抗联合瑞拉利单抗与纳武利尤单抗单药的治疗【6】。
可以看到,纳武利尤单抗联合瑞拉利单抗相较于对照组,显著延长PFS(中位:10.1 vs 4.6个月),降低了25%的疾病进展或死亡风险(HR 0.75,P=0.006)。在不良事件方面,3-4级治疗相关不良事件有较为明显的提升,但整体不良反应均在可接受范围内。
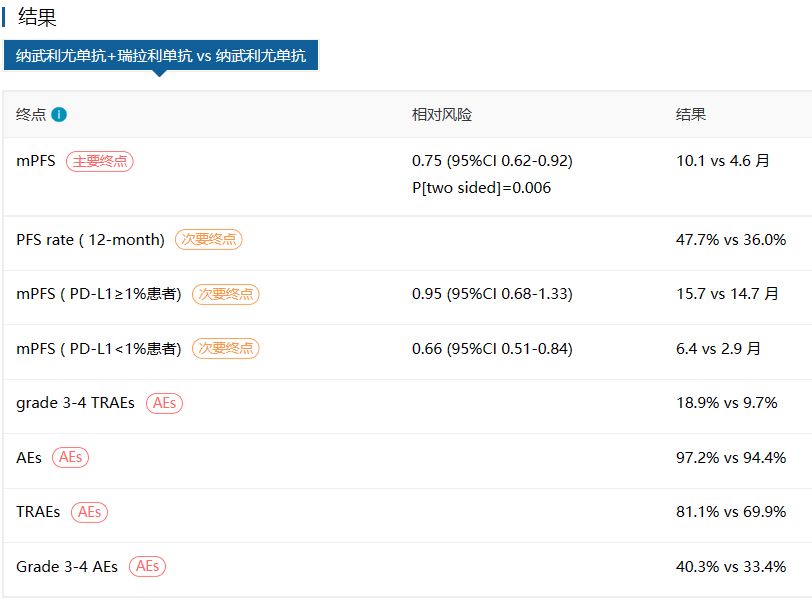 图:RELATIVITY-047研究主要结果(来源:医药魔方DeepMed数据库)
因此,在一线治疗转移性或不可切除的黑色素瘤患者中,与单独抑制 PD-1 相比,抑制两个免疫检查点 LAG-3 和 PD-1 显著改善了患者的无进展生存。这项研究证据也随后很快被纳入了NCCN2022年第3版皮肤黑素瘤指南。
魔方点评:LAG-3是继PD-1/PD-L1和CTLA-4后,第三个上市的免疫抑制剂靶点。类似于它的两个前辈靶点,活化T细胞表面高表达的LAG-3与肿瘤自身表达的LAG-3配体相结合后,抑制了T细胞功能,进而实现肿瘤的免疫逃逸。
图:RELATIVITY-047研究主要结果(来源:医药魔方DeepMed数据库)
因此,在一线治疗转移性或不可切除的黑色素瘤患者中,与单独抑制 PD-1 相比,抑制两个免疫检查点 LAG-3 和 PD-1 显著改善了患者的无进展生存。这项研究证据也随后很快被纳入了NCCN2022年第3版皮肤黑素瘤指南。
魔方点评:LAG-3是继PD-1/PD-L1和CTLA-4后,第三个上市的免疫抑制剂靶点。类似于它的两个前辈靶点,活化T细胞表面高表达的LAG-3与肿瘤自身表达的LAG-3配体相结合后,抑制了T细胞功能,进而实现肿瘤的免疫逃逸。
不同之处在于,LAG-3的表达除了在CD4+/CD8+T细胞,还在调节性T细胞(Treg)和耗竭T细胞等细胞表面表达。有研究表明,拮抗性的LAG-3抗体不但可以像PD-1/PD-L1和CTLA-4抗体一样激活效应T细胞,还可以解除Treg细胞的抑制活性,具有双重作用机制。而耗竭T细胞往往是经过长期慢性感染,使得CD4+、CD8+T细胞上LAG-3受体以及其他抑制性受体高度且持续的表达,导致T细胞失去原有效应功能所形成。对于涉及耗竭T细胞浸润的恶性肿瘤,一些研究显示,PD-1/CTLA-4阻断剂的低敏感性主要是由于该免疫逃逸是由LAG-3介导的。因此,以阻断LAG-3为目标的LAG-3抗体或为肿瘤领域免疫疗法带来新的期望。配体方面,最主要的配体是MHC II类分子,主要在抗原呈递细胞表达,另外还有三种已发现的配体,分别为GAL-3/LSECtin/GFL1,在肿瘤微环境中都发挥着重要的作用。
对于免疫抑制剂疗法,我们通常面临的两大难点,一是局限的缓解率,达不到我们所设想的治疗效果,二是免疫相关的不良事件,过多的细胞因子释放或损伤到正常的人体器官。而当两个不同靶向的免疫抑制剂同时使用的时候,其结果也更难去预测。治疗效果是否能1+1>2?是否会引起更多更高等级的免疫相关不良事件?
过往PD-1/PD-L1与CTLA-4的联用也许没有给出明确的答案。但从PD-1与LAG-3的双免复合剂在初治黑色素瘤的结果来看,它给出了肯定的答案。
目前,在LAG-3赛道上除了批准上市的Opdualag,紧随其后的有3项III期临床,24项其他阶段的在研临床,以及26项的临床前和申报临床阶段。
单看3项III期临床,分别涉及到:添加了重组人玻璃酸酶的纳武利尤单抗/瑞拉利单抗双免复合剂,用药方式从静脉注射变为皮下注射,更加方便给药;以及复合剂MK-4280A,LAG-3抑制剂favezelimab(MK-4280)与帕博利珠单抗的固定剂量复合剂;以及Fianlimab,LAG-3单抗。
目前,MK-4280A已完成一项末线单药治疗晚期微卫星稳定的结直肠癌的I期临床研究,ORR为6.3%。另有三项末线的临床研究在进行,适应症涉及霍奇金淋巴瘤和结直肠癌。特别之处在于,一是它选择了非黑色素瘤的其他癌种从末线开始探索,二是它有两项在研的试验,地点仅为中国,并没有做国际多中心,可能是策略上进行国内优先上市的考虑。
而对于再生元的LAG-3单抗Fianlimab,已完成的一项I期试验可以看出,其联合自家PD-1抑制剂西米普利单抗在既往未接受PD-1/PD-L1抗体治疗的黑色素瘤患者中,ORR达到62.5%,mPFS可达到14.2个月。目前,两项在进行的III期,对照组均设置了帕博利珠单抗,直接选择挑战一线和辅助的黑素瘤标准治疗方案。
Teclistamab
Teclistamab是全球首款获批上市的CD3/BCMA双抗,也是多发性骨髓瘤(MM)领域首款双抗。2022年8月24日,FDA批准Teclistamab用于治疗既往接受过至少3种疗法(免疫调节剂、蛋白酶体抑制剂、抗CD38抗体等)的复发或难治性多发性骨髓瘤。
获批证据:该产品获批基于一项I/II期单臂临床试验MajesTEC-1研究。作为一项MM患者的末线方案,其ORR达到了63%,且有39.4%的患者达到完全缓解,mDOR也达到了18.4个月。在AE方面,CRS的发生率为72.1%【7】。FDA的获批信息公告中也明确提到了对于处方该药物关于致命的细胞因子释放综合征和神经毒性的黑框警告。
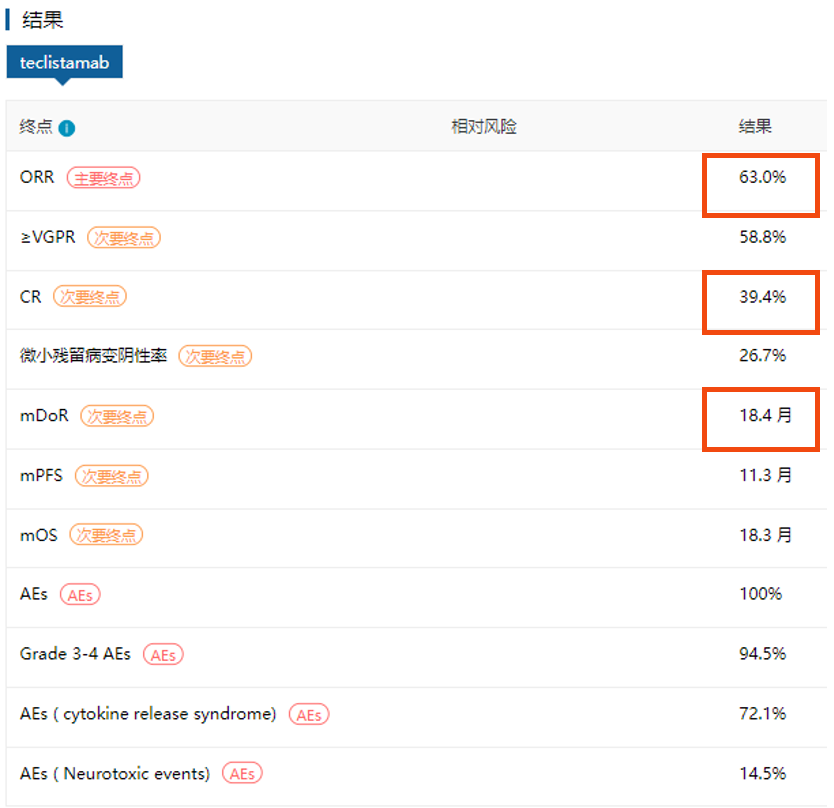 图:MajesTEC-1研究主要结果(来源:医药魔方DeepMed数据库)
图:MajesTEC-1研究主要结果(来源:医药魔方DeepMed数据库)
因此研究提示,复发或难治多发性骨髓瘤接受Teclistamab可获得较高的持续、深度缓解。血细胞减少和感染很常见,多为1或2级。基于该研究,Teclistamab获得了该适应症,相关证据也写入NCCN2023年第2版多发性骨髓瘤指南。
魔方点评:双特异性抗体(bispecificantibody,BsAb)也称“双抗”,是通过细胞融合或重组DNA技术制备的人工抗体,可以特异性结合两种抗原或同一抗原的两个不同表位。
双抗可以通过桥联细胞、桥联受体、桥联因子等方式发挥作用。与单抗相比,双抗或可以直接介导免疫细胞对肿瘤的杀伤,增强对免疫细胞的激活,激发细胞更强的内吞作用,具有更强的特异性、靶向性,降低脱靶毒性。BsAb作用机制创新的方式包括通过空间重排产生新的药效、通过时间维度实现搭载运输功能(“背负式运输”)等。
根据NextPharma数据库显示,血液肿瘤领域目前共有155个在研双抗,3款产品获批血液肿瘤适应症,2款新药正在申请上市,2款处于III期。
表:血液肿瘤领域部分在研及获批上市双抗(来源:医药魔方NextPharma数据库)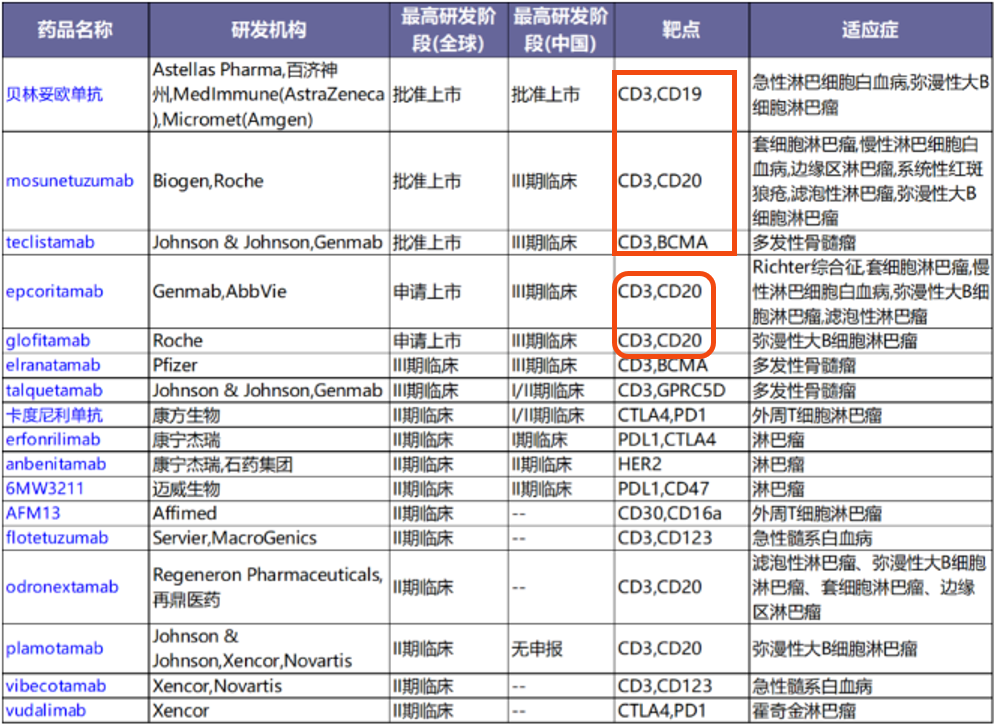 已上市的3款产品中,贝林妥欧单抗是一款老药,目前在全球主要地区均以上市,适应症主要为B细胞急性淋巴细胞白血病。罗氏的CD20/CD3双抗Mosunetuzumab于今年在欧盟获得有条件上市许可,同时也已获得FDA突破性疗法认定,用于至少接受过2种全身治疗方案的复发或难治滤泡性淋巴瘤(FL)成年患者,完全缓解率高达60%,且耐受性良好。其他研究方向还有和pola联用,治疗复发/难治B细胞非霍奇金淋巴瘤。
另外,2款已提交申请的新药均为CD3/CD20双抗,分别来自艾伯维和罗氏。艾伯维的双抗Epcoritamab是通过DuoBody技术平台开发而来,可皮下注射,是一种全长的双特异性IgG1型抗体,半衰期较长,且沉默了Fc段功能。该药已在11月获得美国FDA优先审评,适应症为复发/难治的大B细胞淋巴瘤。
罗氏的双抗Glofitamab同样是一种IgG1样双特异性抗体,具有独特的2:1结构,含有两个靶向CD20的Fab区,研究显示,亲和力较传统1:1式提高10-1000倍。已在中国获得突破性疗法认定用于弥漫大B细胞淋巴瘤。
在多发性骨髓瘤的双抗赛道上,近期强生的另一款CD3/GPRC5D双抗Talquetamab也已向FDA提交了上市申请。该上市申请依据的是TAL-1 phase 1/2的临床数据,在剂量为0.4mg/kg时,ORR达到74.1%,其中完全患者的患者有33.6%,并且发现对于三重难治和五重难治的患者,其ORR与总体人群的ORR相当。CRS的发生率为79%,G3/4为2.1%,较为可控。
此外,辉瑞的一款CD3/BCMA双抗Elranatamab已进入III期临床试验阶段。在今年ASCO上,辉瑞的两项试验MagnetisMM-1和MagnetisMM-3分别发布了更新结果和中期结果。MagnetisMM-3试验纳入的患者至少对蛋白酶体抑制剂、免疫调节剂和抗CD38单克隆抗体中的一种药物难治,其中期结果显示ORR为60.6%,CRS发生率为60.6%,没有高于G3的CRS或ICANS事件发生。但在过程中,该试验被叫停过一次,原因是出现3例外周神经损伤的患者。
同时,在今年ASCO上,MagnetisMM-5的试验方案也做了汇报,第一阶段的数据结果在今年ASH会议上刚刚公布。ORR达到了71%,CRS发生率为47%,且均为G1/2,没有ICANS和DLT事件发生。
已上市的3款产品中,贝林妥欧单抗是一款老药,目前在全球主要地区均以上市,适应症主要为B细胞急性淋巴细胞白血病。罗氏的CD20/CD3双抗Mosunetuzumab于今年在欧盟获得有条件上市许可,同时也已获得FDA突破性疗法认定,用于至少接受过2种全身治疗方案的复发或难治滤泡性淋巴瘤(FL)成年患者,完全缓解率高达60%,且耐受性良好。其他研究方向还有和pola联用,治疗复发/难治B细胞非霍奇金淋巴瘤。
另外,2款已提交申请的新药均为CD3/CD20双抗,分别来自艾伯维和罗氏。艾伯维的双抗Epcoritamab是通过DuoBody技术平台开发而来,可皮下注射,是一种全长的双特异性IgG1型抗体,半衰期较长,且沉默了Fc段功能。该药已在11月获得美国FDA优先审评,适应症为复发/难治的大B细胞淋巴瘤。
罗氏的双抗Glofitamab同样是一种IgG1样双特异性抗体,具有独特的2:1结构,含有两个靶向CD20的Fab区,研究显示,亲和力较传统1:1式提高10-1000倍。已在中国获得突破性疗法认定用于弥漫大B细胞淋巴瘤。
在多发性骨髓瘤的双抗赛道上,近期强生的另一款CD3/GPRC5D双抗Talquetamab也已向FDA提交了上市申请。该上市申请依据的是TAL-1 phase 1/2的临床数据,在剂量为0.4mg/kg时,ORR达到74.1%,其中完全患者的患者有33.6%,并且发现对于三重难治和五重难治的患者,其ORR与总体人群的ORR相当。CRS的发生率为79%,G3/4为2.1%,较为可控。
此外,辉瑞的一款CD3/BCMA双抗Elranatamab已进入III期临床试验阶段。在今年ASCO上,辉瑞的两项试验MagnetisMM-1和MagnetisMM-3分别发布了更新结果和中期结果。MagnetisMM-3试验纳入的患者至少对蛋白酶体抑制剂、免疫调节剂和抗CD38单克隆抗体中的一种药物难治,其中期结果显示ORR为60.6%,CRS发生率为60.6%,没有高于G3的CRS或ICANS事件发生。但在过程中,该试验被叫停过一次,原因是出现3例外周神经损伤的患者。
同时,在今年ASCO上,MagnetisMM-5的试验方案也做了汇报,第一阶段的数据结果在今年ASH会议上刚刚公布。ORR达到了71%,CRS发生率为47%,且均为G1/2,没有ICANS和DLT事件发生。
版权声明
本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->

 图:HIMALAYA研究主要结果(来源:医药魔方DeepMed数据库)
图:HIMALAYA研究主要结果(来源:医药魔方DeepMed数据库) 图:POSEIDON研究主要结果(来源:医药魔方DeepMed数据库)
图:POSEIDON研究主要结果(来源:医药魔方DeepMed数据库) 图:替西木单抗临床研发历程(来源:医药魔方NextPharma数据库)
图:替西木单抗临床研发历程(来源:医药魔方NextPharma数据库)
 图:DESTINY-Breast 03研究主要结果(来源:医药魔方DeepMed数据库)
图:DESTINY-Breast 03研究主要结果(来源:医药魔方DeepMed数据库) 图:DESTINY-Breast 04研究主要结果(来源:医药魔方DeepMed数据库)
图:DESTINY-Breast 04研究主要结果(来源:医药魔方DeepMed数据库) 图:DESTINY-Lung02研究主要结果(来源:医药魔方DeepMed数据库)
图:DESTINY-Lung02研究主要结果(来源:医药魔方DeepMed数据库) 图:德曲妥珠单抗获批适应症情况(来源:医药魔方NextPharma数据库)
图:德曲妥珠单抗获批适应症情况(来源:医药魔方NextPharma数据库)
 图:RELATIVITY-047研究主要结果(来源:医药魔方DeepMed数据库)
图:RELATIVITY-047研究主要结果(来源:医药魔方DeepMed数据库) 图:MajesTEC-1研究主要结果(来源:医药魔方DeepMed数据库)
图:MajesTEC-1研究主要结果(来源:医药魔方DeepMed数据库)


