Cell子刊:激活GCN2,可代谢重编程T细胞,增强其抗肿瘤免疫
来源:生物世界 2024-03-14 14:21
使用GCN2激动剂halofuginone(halo)激活氨基酸饥饿反应可以增强T细胞代谢及其抗肿瘤活性。
多伦多大学的研究人员在 Cell 子刊 Cell Reports Medicine 上发表了题为:Ex vivo activation of the GCN2 pathway metabolically reprograms T cells, leading to enhanced adoptive cell therapy 的研究论文。
该研究证实,体外激活GCN2通路可代谢重编程T细胞,从而增强过继细胞治疗效果。

操纵T细胞代谢已成为增强过继细胞治疗(ACT)疗效的诱人途径。之前的研究显示,在临床前模型中,通过药物或基因增强T细胞的线粒体氧化磷酸化(OXPHOS)可以改善对肿瘤的控制。有趣的是,最近还有研究发现,体外短暂葡萄糖饥饿也可以导致T细胞的代谢重编程和更好的肿瘤控制。这些数据表明,进化上保守的代谢应激通路可能是提高ACT疗效的诱人目标。
GCN2激酶是氨基酸饥饿的重要传感器,一旦被激活,GCN2将释放出大量蛋白质,包括TNF-α、IL-6和IL-10。这些蛋白质可以促进细胞的生长和分裂,从而提高细胞的免疫应答能力。GCN2磷酸化真核起始因子2a并诱导蛋白质翻译重编程,从而普遍抑制全局蛋白质翻译,同时促进转录激活因子4(ATF4)和其他参与细胞自噬和蛋白质摄取诱导的转录因子的表达,以协调基因和蛋白质表达的程序,称为综合应激反应(ISR)。
GCN2-ATF4诱导的综合应激反应(ISR)在CD8+ T细胞和抗肿瘤免疫中的作用尚不清楚。早期研究表明,吲哚胺2,3-双加氧酶1(IDO1)活性导致色氨酸耗竭而激活GCN2,抑制了CD8+ T细胞的功能和增殖。相反,缺乏GCN2的T细胞在激活过程中存在增殖缺陷。在小鼠胶质瘤模型中,缺乏GCN2的CD8+ T细胞表现出受损的抗肿瘤免疫。然而,在B16黑色素瘤模型中,GCN2的特异性缺失并未影响抗肿瘤免疫。
鉴于上述相互矛盾的研究结果,该研究团队尝试确定GCN2通路的激活对效应性CD8+ T细胞的代谢、效应器功能和抗肿瘤能力的影响。
在这项最新研究中,研究团队发现,使用GCN2激动剂halofuginone(halo)在体外激活效应性CD8+ T细胞的氨基酸饥饿反应,可以增强其氧化代谢和效应器功能。
从机制上来说,该研究确定了自噬与CD98-mTOR信号轴是halo治疗所诱导的表型的关键下游介质。将halo处理的CD8+ T细胞过继转移到荷瘤小鼠模型中,导致了强大的肿瘤控制和治愈反应。在体内,halo处理的T细胞与4-1BB激动性抗体协同作用,在免疫治疗耐药的小鼠模型中抑制了肿瘤生长。重要的是,使用halo处理人类CD8+ T细胞也导致了类似的代谢和功能重编程。
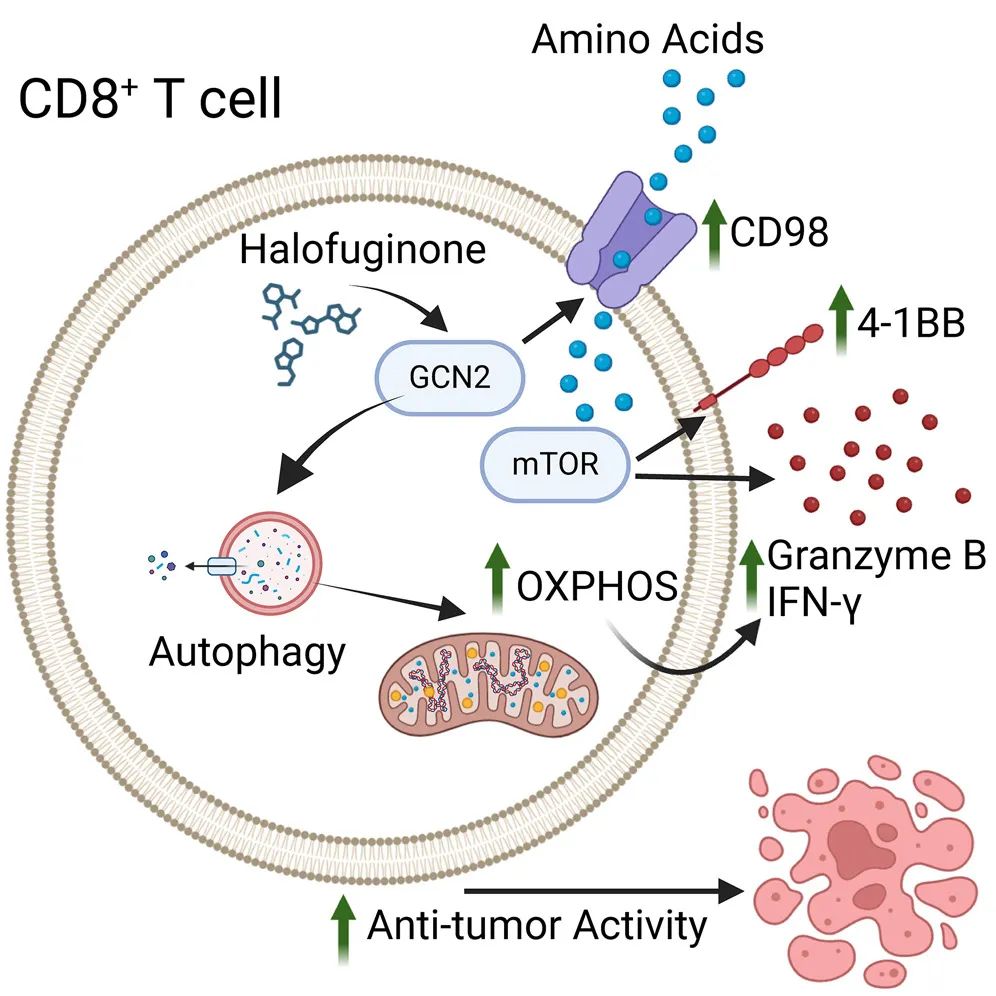
这些发现表明,使用GCN2激动剂halofuginone(halo)激活氨基酸饥饿反应可以增强T细胞代谢及其抗肿瘤活性。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


