LNP共递送mRNA和siRNA,构建PD-1被抑制的超级CAR-T细胞
来源:生物世界 2023-09-27 11:19
这些“超级”CAR-T细胞在完成其功能后,可以恢复正常患者T细胞的功能,大大限制了由于CAR表达和PD-1抑制而产生的脱靶效应。
CAR-T细胞疗法作为临床上治疗癌症和其他疾病的强大工具,近年来继续获得关注。基于CAR-T的疗法已被批准用于治疗急性淋巴细胞白血病(ALL)、B细胞淋巴瘤和多发性骨髓瘤等血液类癌症,并正在被研究用于治疗非小细胞肺癌、胶质母细胞瘤、艾滋病、心脏病,以及自身免疫疾病等等。
CAR-T细胞疗法的治疗疗效的主要来源是这些疗法利用患者自身的免疫系统对癌细胞等致病细胞发动复杂攻击的能力。然而,CAR-T细胞疗法作为免疫系统延伸的性质意味着,经过工程改造的CAR-T细胞易受肿瘤微环境(TME)中的免疫抑制信号的影响,这阻碍了CAR-T的疗效。
程序性细胞死亡蛋白1(PD-1)信号通路已被证实是肿瘤微环境(TME)中T细胞活性的主要抑制因子,包括在进行过继CAR-T细胞疗法时。PD-1是一种免疫检查点受体,表达于活化T细胞表面,PD-1在与其配体PD-L1或PD-L2结合后,PD-1启动免疫抑制反应,通过促进效应T细胞的凋亡和抑制调节性T细胞的凋亡来抑制炎症性T细胞活性。
虽然PD-L2的表达相对受限,但PD-L1在多种癌症中过度表达,被认为在免疫逃逸和CAR-T细胞疗效下降中发挥着重要作用。因此,抑制PD-1和PD-L1之间的相互作用可作为一种潜在手段,在PD-L1高表达的肿瘤微环境(TME)中挽救CAR-T疗效。
近日,宾夕法尼亚大学 Michael Mitchell 教授团队联合CAR-T细胞疗法先驱 Carl June 教授和mRNA技术先驱 Drew Weissman 教授,在 Advanced Healthcare Materials 期刊发表了题为:Ionizable Lipid Nanoparticles with Integrated Immune Checkpoint Inhibition for mRNA CAR T Cell Engineering 的研究论文。
该研究使用可电离脂质纳米颗粒共封装和递送CAR mRNA和靶向PD-1的siRNA,结果显示,这种共封装会产生协同作用,进一步提高mRNA的表达和siRNA的敲低效率,从而构建瞬时的PD-1抑制的CAR-T细胞,

使用抗体来阻断PD-1和/或其配体,是克服免疫抑制性PD-1通路的一种广泛使用的临床策略。虽然将阻断抗体与CAR-T细胞疗法结合是一种有用的方法,但游离抗体的施用会导致PD-1信号的广泛抑制,并有可能引起自身免疫反应。
由于CAR-T疗法已经需要对自体T细胞进行工程改造来表达外源性CAR,因此有可能结合靶向PD-1抑制,来产生PD-1信号被抑制的CAR-T细胞,同时保证PD-1通路在其他地方的完整。
之前已有一些研究探索了几种与CAR工程一起破坏PD-1通路的方法,并获得了有希望的效果,例如,使用CRISPR-Cas9基因编辑技术敲除PD-1基因,工程化可溶性抗PD-1单链可变区片段(scFv)的整合,以及使用shRNA靶向抑制PD-1的表达。然而,这些方法大多依赖于使用病毒递送载体和/或CRISPR-Cas9基因编辑,从而会改变基因组。这意味着这些对PD-1抑制的措施是永久性的,产生了对这种抗炎信号通路永久脱敏的T细胞,这为自身免疫反应打开了大门。
实际上,T细胞有一种内源性机制,通过RNA诱导的沉默复合(RISC)来短暂抑制遗传转录物。因此,利用RNA干扰(RNAi)在转录组水平上对PD-1信号通路的短暂抑制,提供了一种有吸引力且未被充分探索的替代方法。
Michael Mitchell 教授团队此前开发了一种非病毒载体平台,使用可电离脂质纳米颗粒(LNP)递送编码CAR的mRNA来生产瞬时CAR-T细胞。
在这项新研究中,Michael Mitchell 教授联合CAR-T细胞疗法先驱 Carl June 教授和mRNA技术先驱 Drew Weissman 教授,进一步增强了上述非病毒载体平台,让外源性mRNA在表达的同时使用RNAi瞬时破坏任意内源性基因成为可能。
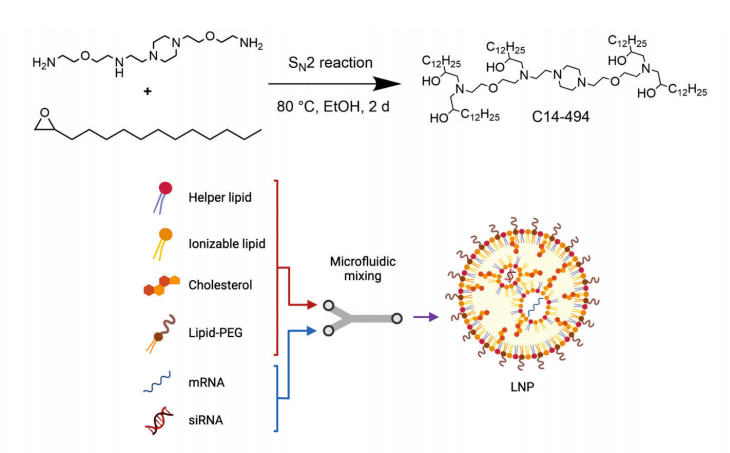
研究团队使用工程化LNP平台将CAR-mRNA和靶向PD-1 mRNA的siRNA递送到体外T细胞,产生具有强大但瞬时的CAR表达和短暂的细胞内PD-1被破坏的人类CAR-T细胞,且细胞的整体活化状态没有改变。
这些“超级”CAR-T细胞在完成其功能后,可以恢复正常患者T细胞的功能,大大限制了由于CAR表达和PD-1抑制而产生的脱靶效应。
进一步研究显示,使用LNP共封装导致其中的mRNA和siRNA之间的有趣相互作用,与单独递送其中一种相比,共封装导致了递送后的mRNA表达升高和siRNA敲低效果改善。这表明即使在不需要基因沉默的应用中,siRNA的共封装也可能有利于LNP介导的mRNA递送。
更重要的是,这种递送平台在许多免疫工程应用中显示了瞬时免疫基因调控的巨大前景,包括开发改进的癌症免疫疗法。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


