Nature子刊:浙大张丹团队揭示卵母细胞铁死亡在卵巢功能不全发病中的作用及机制
来源:生物世界 2022-10-12 10:33
课题组深入阐明了BNC1基因突变通过BNC1-NF2-YAP-TFRC/ACSL4信号通路致卵巢功能不全的分子机制,首次报道了卵母细胞铁死亡在卵巢功能不全发生中的作用机理
卵巢功能不全(primary ovarian insufficiency,POI)作为主要的疑难生殖障碍疾病之一,指女性在40岁之前发生卵巢功能衰竭,发病率呈持续上升趋势。其除可致不孕不育、早发绝经外,还影响女性全身健康状态,增加心血管疾病、骨质疏松、神经精神障碍疾病等全身性疾病发生风险,全因死亡率亦显著升高,严重损害女性健康。但当前对其病因机制尚不明晰,临床有效治疗方法欠缺。
近日,浙江大学医学院附属妇产科医院张丹课题组在 Nature Communications 期刊发表了题为:BNC1 deficiency-triggered ferroptosis through the NF2-YAP pathway induces primary ovarian insufficiency 的研究论文。
该研究首次报道卵母细胞铁死亡在卵巢功能不全发病中的作用及机制,揭示了BNC1基因截短突变通过NF2-YAP-TFRC/ACSL4信号通路致卵母细胞脂代谢异常和氧化还原稳态失调、并进而发生铁死亡的分子机理,为卵巢功能不全临床精准防治提供新的理论基础。

张丹教授团队前期在一个涉及四代的大型中国人卵巢功能不全家系中,通过基因组全外显子测序和 Sanger测序,鉴定到一个新的卵巢功能不全相关致病基因突变:Basonuclin1(BNC1)基因截短突变,(NM_001717.3:c.1065_1069del/p.Arg356Valfs*6),并通过转基因小鼠动物模型确证BNC1截短突变会导致卵巢功能不全的发生(Human Molecular Genetics,2018)。
本研究中,张丹教授团队进一步深入探究了BNC1基因截短突变致卵巢功能不全发生的具体调控机制。通过构建卵母细胞Bnc1特异性敲除小鼠模型,发现BNC1主要通过干扰卵母细胞发育影响小鼠卵巢储备。
已有的Bnc1截短突变小鼠其卵泡发生提前过度激活和闭锁耗竭,且卵母细胞Smart-seq测序分析提示Bnc1截短突变小鼠脂代谢与线粒体功能异常、Hippo通路和铁死亡(ferroptosis)通路异常。进一步研究发现Bnc1截短突变小鼠卵母细胞铁死亡相关指标水平异常,且铁死亡相关表型被铁死亡激动剂RLS3诱导加剧,并能被铁死亡拮抗剂 ferrostatin-1(Fer-1)逆转,提示Bnc1截短突变致卵母细胞发生铁死亡。
为阐明Bnc1截短突变诱发卵母细胞铁死亡的分子机理,张丹教授团队通过染色质免疫沉淀及测序(ChIP-seq)、ChIP-qPCR和双荧光素酶报告基因实验等发现并确证BNC1的下游靶基因Nf2,明确了NF2介导Hippo-YAP-TFRC/ACSL4 通路调控卵母细胞铁死亡的作用机制,并通过靶向NF2-YAP逆转了卵母细胞铁死亡导致的卵巢功能不全表型。
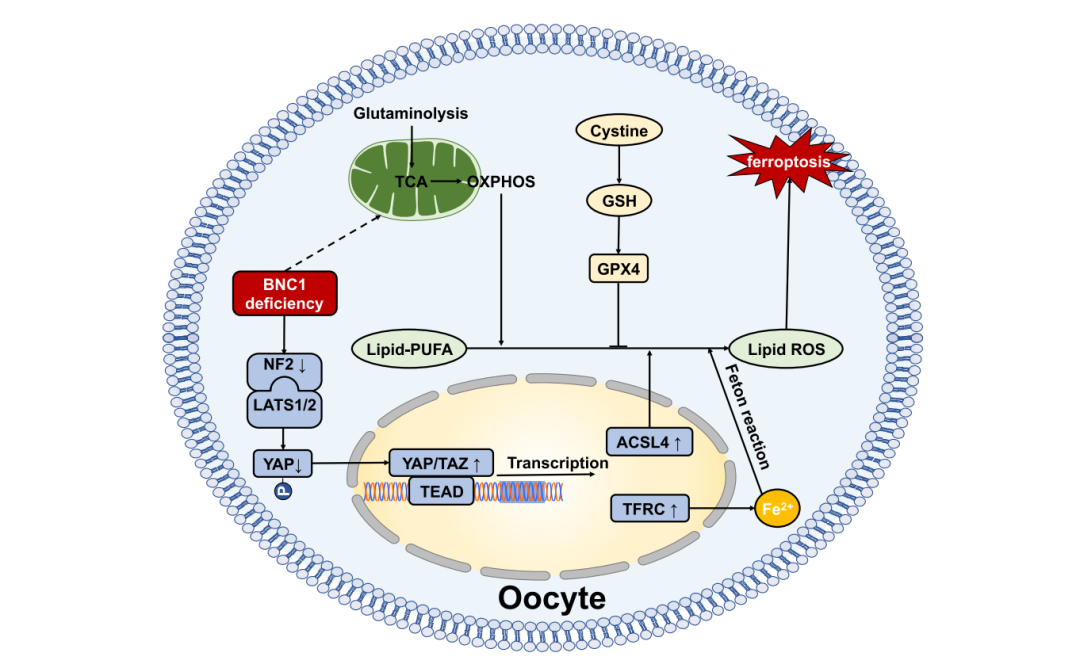
BNC1-NF2-Hippo-YAP-TFRC/ACSL4信号传导-铁死亡轴模式图
在该研究中,课题组深入阐明了BNC1基因突变通过BNC1-NF2-YAP-TFRC/ACSL4信号通路致卵巢功能不全的分子机制,首次报道了卵母细胞铁死亡在卵巢功能不全发生中的作用机理,并建立了基于铁死亡挽救的卵巢功能不全潜在治疗新方法,为解析卵巢功能不全发病机制、攻克当前卵巢功能不全有效缓解和逆转治疗策略不足的临床瓶颈难题提供了新思路。
浙江大学医学院附属妇产科医院为该论文第一通讯单位。论文的通讯作者是教育部生殖遗传重点实验室常务副主任、浙江大学医学院附属妇产科医院张丹教授。论文的第一作者为浙江大学医学院妇产科学博士生汪非遐、浙江大学医学院附属妇产科医院刘益枫博士、浙江大学医学院八年制博士生倪飞达。该研究工作受到国家重点研发计划、国家自然科学基金、浙江省重点研发计划的资助。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


