针对新冠病毒SARS-CoV-2/COVID-19,Nature期刊研究进展一览(第2期)
来源:本站原创 2020-06-29 23:59
2020年6月29日讯/生物谷BIOON/---自2019年12月8日以来,中国湖北省武汉市报告了几例病因不明的肺炎。大多数患者在当地的华南海鲜批发市场工作或附近居住。在这种肺炎的早期阶段,严重的急性呼吸道感染症状出现了,一些患者迅速发展为急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)、急性呼吸衰竭和
2020年6月29日讯/生物谷BIOON/---自2019年12月8日以来,中国湖北省武汉市报告了几例病因不明的肺炎。大多数患者在当地的华南海鲜批发市场工作或附近居住。在这种肺炎的早期阶段,严重的急性呼吸道感染症状出现了,一些患者迅速发展为急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)、急性呼吸衰竭和其他的严重并发症。2020年1月7日,中国疾病预防控制中心(China CDC)从患者的咽拭子样本中鉴定出一种新型冠状病毒,最初被世界卫生组织(WHO)命名为2019-nCoV。大多数2019-nCoV肺炎患者的症状较轻,预后良好。到目前为止,一些患者已经出现严重的肺炎,肺水肿,ARDS或多器官功能衰竭和死亡。
2020年2月11日,世卫组织将这种疾病病重命名为2019年冠状病毒病(COVID-19)。同一天,负责分类和命名病毒的的国际病毒分类学委员会的冠状病毒研究小组在bioRxiv上发表了一篇文章,指出该研究小组已经决定,新型冠状病毒2019-nCoV是导致2002-2003年爆发严重急性呼吸综合征(SARS)冠状病毒(SARS-CoV)的变种。因此,将这种新病原体重新命名为严重急性呼吸综合征冠状病毒2号(severe acute respiratory syndrome coronavirus 2),或SARS-CoV-2。值得注意的一点是,尽管国际病毒分类委员会冠状病毒研究小组将病毒命名为SARS-CoV-2,但该研究小组主席John Ziebuhr认为这个名字(SARS-CoV-2)和SARS(严重急性呼吸综合征,也称非典型肺炎)没有关联。不过,这种病毒的重新命名引起了不少争议。据《科学》网站报道,世界卫生组织不满意SARS-CoV-2这个名字,而且不打算采用此名称。
冠状病毒可引起多种动物的多系统感染。在此之前已有6种冠状病毒可以感染人类,它们主要引起人类的呼吸道感染:两种高度致命性的冠状病毒,即严重急性呼吸道综合征(SARS)冠状病毒(SARS-CoV)和中东呼吸综合征(MERS)冠状病毒(MERS-CoV);4种可导致温和的上呼吸道疾病的冠状病毒,即HCoV-OC43、HCoV-229E、HCoV-NL63和HCoV-HKU1。
基于此次疫情给中国和全世界带来严重的危害,小编针对Nature期刊上发表的2019-nCoV/COVID-19研究进行一番梳理,以飨读者。
1.Nature:COVID-19康复者对SARS-CoV-2的抗体反应
doi:10.1038/s41586-020-2456-9
在COVID-19大流行期间,SARS-CoV-2感染了数百万人,夺去了数十万人的生命。病毒进入宿主细胞取决于SARS-CoV-2刺突蛋白(S)的受体结合结构域(RBD)。虽然没有疫苗,但抗体很可能是保护的关键。然而,对SARS-CoV-2的人类抗体反应知之甚少。在一项新的研究中,Davide F. Robbiani等人报告了149名COVID-19康复者。在症状发生平均39天后收集到的血浆具有不同的半数最大假病毒中和滴度(half-maximal pseudovirus neutralizing titre):33%的人小于1:50,79%的人低于1:1000,而只有1%的人显示滴度高于1:5000。抗体测序显示在不同个体中表达密切相关抗体的RBD特异性记忆B细胞的扩增克隆。尽管血浆滴度较低,但RBD上三个不同表位的抗体中和的半数最大抑制浓度(IC50值)低至个位数纳克/毫升。因此,从COVID-19康复者身上获得的大多数康复期血浆不含有高水平的中和活性。然而,在所有被测试的人中都发现了罕见但反复出现的具有强大抗病毒活性的RBD特异性抗体,这表明为引起这类抗体而设计的疫苗可能广泛有效。
2.Nature:重大发现!一种人类抗体可以强效中和包括SARS-CoV和SARS-CoV-2在内的多种冠状病毒
doi:10.1038/s41586-020-2349-y
在一项新的研究中,来自瑞士Humabs生物医学公司(Humabs Biomed SA)和美国华盛顿大学的研究人员发现在2003年从一名严重急性呼吸综合征(SARS,俗称非典型肺炎)患者的血液样本中首次鉴定出的一种抗体可抑制相关的冠状病毒,包括导致2019年冠状病毒病(COVID-19)的新型冠状病毒SARS-CoV-2。这种称为S309的抗体目前在Vir生物技术公司(下称Vir公司)已进入快速开发和测试轨道,下一步可能进行临床试验。相关研究结果于2020年5月18日在线发表在Nature期刊上,论文标题为“Cross-neutralization of SARS-CoV and SARS-CoV2 by a human monoclonal antibody”。论文通讯作者为华盛顿大学医学院生物化学助理教授David Veesler和Vir子公司Humabs生物医学公司的Davide Corti。论文第一作者为Humabs生物医学公司的Dora Pinto和Martina Beltramello,以及Veesler实验室的Young-Jun Park和Lexi Walls。这四名论文第一作者多年来一直在研究多种冠状病毒的感染性复合物的结构和功能。
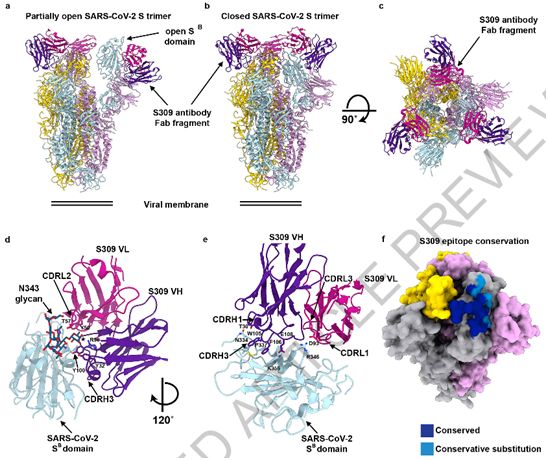
通过低温电镜研究和结合测试实验,这些研究人员了解到S309抗体识别冠状病毒表面上的一个结合位点,这个结合位点在β冠状病毒属sarbocovirus亚属的许多病毒中都是保守的,而不仅仅是在SARS-CoV(导致SARS的冠状病毒)和SARS-CoV-2病毒中是保守的。这大概就是为什么这种抗体不是仅对一种冠状病毒而是对多种相关的冠状病毒起作用。将S309抗体与康复后的SARS患者中发现的其他较弱的抗体相结合,可增强对SARS-CoV-2病毒的中和作用。
3.Nature重大进展!瑞德西韦对感染SARS-CoV-2的恒河猴有效!
doi:10.1038/s41586-020-2423-5
瑞德西韦(Remdesivir, GS-5734)是一种核苷酸模拟前药,具有广泛的抗病毒活性,目前正在COVID-19临床试验中进行研究,最近获得了美国食品和药物管理局的紧急使用授权。在动物模型中,瑞德西韦治疗对MERS-CoV和SARS-CoV感染是有效的。在体外实验中,瑞德西韦抑制了SARS-CoV-2的复制。
近日来自国立卫生研究院国立过敏和传染病研究所的研究人员研究了瑞德西韦在治疗恒河猴SARS-CoV-2感染模型中的疗效,相关研究成果近日发表在Nature上,题为"Clinical benefit of remdesivir in rhesus macaques infected with SARS-CoV-2"。
研究人员发现,与空白治疗的动物相比,第一次给药12小时后,接受瑞德西韦治疗的动物没有表现出呼吸系统疾病的迹象,x光片显示肺部浸润减少,支气管肺泡灌洗中病毒滴度降低。但是,瑞德西韦治疗未减少上呼吸道病毒脱落。牺牲动物后进行尸检发现,瑞德西韦治疗的动物的肺病毒载量较低,对肺的损害也有所减少。因此,在感染早期开始瑞德西韦治疗对感染SARS-CoV-2的恒河猴有临床疗效。
4.Nature:11个欧洲国家阻止SARS-CoV-2传播的封锁措施避免了300多万人死亡
doi:10.1038/s41586-020-2405-7
根据一项新的模型研究,随着大多数国家都在采取严格措施阻止新冠病毒(SARS-CoV-2)的传播,封锁防止了11个欧洲国家大约310万人的死亡。相关研究结果于2020年6月8日在线发表在Nature期刊上,论文标题为“Estimating the effects of non-pharmaceutical interventions on COVID-19 in Europe”。
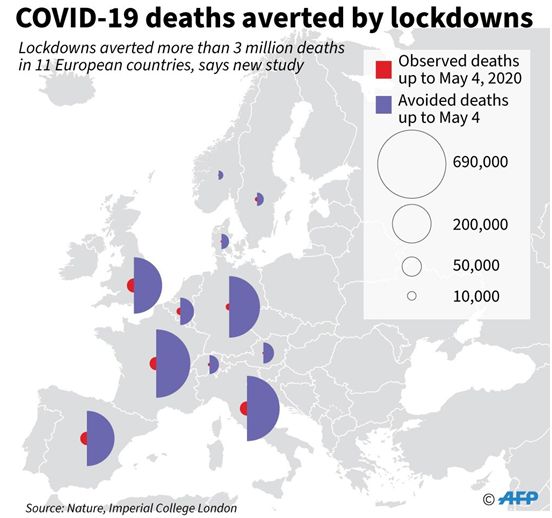
正在就这种冠状病毒向英国政府提供建议的英国帝国理工学院科学家们发现,诸如禁止外出等限制措施对控制疫情起到了作用。通过使用欧洲疾病控制中心提供的截至5月4日11个欧洲国家的死亡数据,他们发现将在这些国家观察到的死亡人数与他们的模型所预测的在没有实施限制措施时的死亡人数进行了比较。他们估计,这些政策避免了大约310万人的死亡。
这些研究人员还计算出,这些干预措施导致了再生数(reproduction number)---一个感染者可以感染的人数---平均下降了82%,降至1.0以下。
这些研究人员说,“我们的结果表明主要的非药物干预措施,特别是封锁,对减少传播有很大的影响。应该考虑继续进行干预,以控制SARS-CoV-2的传播。”
这些研究人员估计,在此期间累计有1200万至1500万人被感染---或者说占这11个欧洲国家人口的3.2%至4%。感染人数在各国之间波动很大,德国只有71万人被认为感染了这种冠状病毒,占德国人口的0.85%。相比之下,比利时的感染率最高,占比利时人口的8%,而西班牙则有大约5.5%的人口,即260万人,被认为感染了这种冠状病毒。
5.两篇Nature重大进展!中国科学家从病人体内分离出SARS-CoV-2特异性的中和性抗体!
doi:10.1038/s41586-020-2381-y; doi:10.1038/s41586-020-2380-z
由SARS-CoV-2引起的2019冠状病毒病(COVID-19)在全球暴发,是目前的全球卫生紧急事件,急需治疗性药物以及预防性疫苗缓解疫情。抗体是治疗COVID-19的有效药物之一,目前已有不少临床试验正在使用恢复的病人的血清进行治疗,但是这种方法难以批量生产,同时病人血清中的抗体数量繁多,特异性不确定,因此效果如何未可知。所以从这些康复的病人体内找出SARS-CoV-2特异性的中和性抗体对于下一步的治疗性抗体的开发和批量生产至关重要。5月26日,Nature杂志同时上线了两篇中国科学家完成的最新研究,分别从病人体内分离出了SARS-CoV-2特异性的高活性中和性抗体。
其中一项研究题为"A human neutralizing antibody targets the receptor binding site of SARS-CoV-2",由中国科学院微生物研究所的严景华团队、高福团队、王奇慧团队与中科院武汉病毒所、国家疾病预防控制中心病毒病研究所、北京地坛医院等机构合作完成。在该研究中,研究人员报告了从一名恢复期COVID-19患者中分离出2种特异性人类单克隆抗体(MAbs):CA1和CB6。
研究人员发现CA1和CB6在体外对SARS-CoV-2表现出了强大的SARS-CoV-2特异性的中和活性。此外,在预防和治疗环境中,CB6都能抑制恒河猴的SARS-CoV-2感染。进一步的结构研究表明,CB6可以识别与SARS-CoV-2受体结合域(RBD)中的血管紧张素转换酶2 (ACE2)结合位点重叠的表位,从而通过空间位阻和直接的界面-残基竞争作用干扰病毒/受体的相互作用。这些研究结果表明,CB6值得进一步的临床研究和转化。
另一项研究题为"Human neutralizing antibodies elicited by SARS-CoV-2 infection",由清华大学医学院张林琦团队和国家感染性疾病临床医学研究中心张政团队及清华大学生命科学学院和结构生物学高精尖创新中心王新泉团队合作完成。
SARS-CoV-2进入靶细胞依赖于病毒刺突蛋白的受体结合域(RBD)和ACE2细胞受体之间的结合。在这项研究中,研究人员报告了从8例SARS-CoV-2感染者的单个B细胞中分离并鉴定206个RBD特异性单克隆抗体。研究人员鉴定了具有有效的抗SARS-CoV-2中和活性的抗体,这些抗体与ACE2结合RBD的竞争能力相关。
令人惊讶的是,尽管发现了大量的针对其三聚刺突蛋白的血浆交叉反应,但无论是抗SARS-CoV-2抗体,还是感染的血浆与SARS-CoV或MERS-CoV RBDs都没有发生交叉反应。RBD结合抗体的晶体结构分析显示空间位阻可以抑制病毒与ACE2的结合,从而阻断病毒的进入。这些发现表明,抗RBD抗体是病毒种特异性抑制剂。这里发现的抗体可能是开发SARS-CoV-2临床干预的候选抗体。
6.Nature突破!揭示SARS-CoV-2复制遗传物质的机制!
doi:10.1038/s41586-020-2368-8
当一个人被新型冠状病毒SARS-CoV-2感染时,病原体在感染者的细胞内迅速增殖。要做到这一点,病毒必须繁殖它的遗传物质,它是由一条长长的RNA链组成的。这个过程是由病毒"复印机"--即所谓的聚合酶来完成的。德国哥廷根马克斯普朗克生物物理化学研究所的Patrick Cramer领导的研究人员现在已经确定了冠状聚合酶的三维结构。这使得现在有可能研究抗病毒药物如瑞德西韦(一种阻断聚合酶的药物)是如何起作用的,并寻找新的抑制物质。
了解冠状病毒聚合酶是如何在原子尺度上构建的,为更好地理解和对抗病原体开辟了新的可能性。下一步,Cramer的团队将详细研究抗病毒物质是如何阻止冠状病毒扩散的。Cramer说"许多希望寄托在直接阻断聚合酶的药物瑞德西韦上。有了这种结构,就有可能优化现有物质,如瑞德西韦等药物,并改善其效果。但我们也想寻找能够阻止病毒聚合酶的新物质。"
7.全文编译!我国科学发表Nature论文,揭示与COVID-19患者临床结果相关的病毒和宿主因素
doi:10.1038/s41586-020-2355-0
目前,关于SARS-CoV-2的起源、进化及其与宿主之间的相互作用仍存在几个问题。首先,尽管HSWM市场被广泛认为是SARS-CoV-2的原始疫情爆发地点,但是在最初的一系列病例中,相当多的病例并没有接触这个市场。这使得人们对最初的疫情爆发时,人畜共患病溢出到人类中的单一事件产生了怀疑。第二,SARS-CoV-2的毒力是否由于疾病传播过程中的基因组序列进化而发生了改变,还有待更多的数据来回答。第三,虽然SARS-CoV-2感染可引起危及生命的呼吸系统疾病,但大多数病例表现为轻度肺炎。迄今为止,与疾病临床结果相关的因素尚未充分描述。
在一项新的研究中,来自中国复旦大学、上海交通大学医学院和中国科学院上海生命科学研究院的研究人员系统地分析了贯穿整个感染过程中的关键免疫学参数,直接从临床样本中获得病毒基因组,并确定了与疾病临床结果和流行病学特征相关的因素。相关研究结果于2020年5月20日在线发表在Nature期刊上,论文标题为“Viral and host factors related to the clinical outcome of COVID-19”。
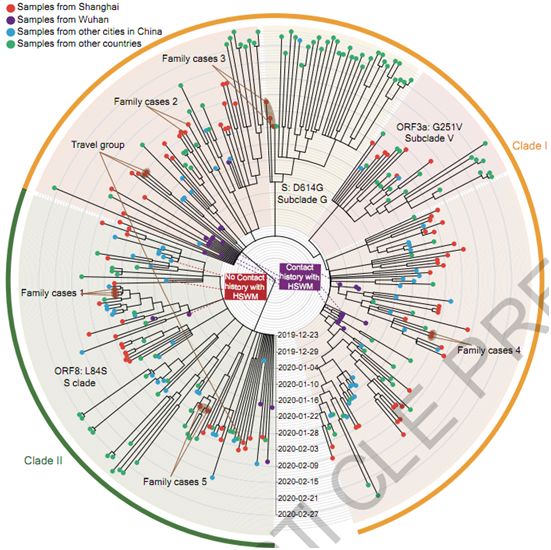
通过密切监测326例COVID-19患者的分子和免疫学数据,这些作者提出不良的临床结果与CD3+ T淋巴细胞衰竭有关,这种衰竭与IL-6和IL-8等细胞因子的急剧增加密切相关。针对1月下旬至2月期间感染的94例病例的靶向测序结果发现这种病毒基因组中的有限变异提示着稳定的进化。来自同一祖先的两个主要病毒谱系可能于2019年12月在武汉独立进化,尽管在临床表现或传播性方面没有发现它们之间存在重大差异。这些数据为揭示病毒和宿主因素在疾病机制中各自发挥的作用提供了进一步的证据,并强调了早期干预治疗的重要性。
8.Nature:新研究揭示潜在的COVID-19治疗靶点
doi:10.1038/s41586-020-2332-7
在一项新的研究中,来自德国歌德大学和法兰克福大学医院的研究人员能够观察到人体细胞在感染SARS-CoV-2---导致人类患上2019年冠状病毒病(COVID-19)的新型冠状病毒---后的变化。他们在实验室模型中测试了一系列化合物,发现了其中的一些化合物可延缓或阻止病毒复制。这些结果如今能够将寻找活性物质的范围缩小到少数已被批准上市的药物上。根据这些发现,一家美国公司报道它正在准备开战临床试验。一家加拿大公司也利用一种不同的活性物质开始了临床研究。相关研究结果于2020年5月14日在线发表在Nature期刊上,论文标题为“Proteomics of SARS-CoV-2-infected host cells reveals therapy targets”。
利用在歌德大学第二生物化学研究所开发的一项技术,来自这两个研究机构的研究人员共同展示了SARS-CoV-2感染是如何改变人类宿主细胞的。他们使用了他们在几个月前开发出的一种特殊形式的质谱法(称为mePROD方法)。这种方法可以测定细胞内成千上万种蛋白的数量和合成率。
这些研究结果描绘了SARS-CoV-2感染的发展过程:尽管许多病毒为了有利于自身病毒蛋白的产生而关闭了宿主的蛋白产生,但是SARS-CoV-2只对宿主细胞的蛋白产生产生轻微的影响,病毒蛋白似乎是在与宿主细胞蛋白的竞争中产生的。相反,SARS-CoV-2感染导致细胞内的蛋白合成复合物增加。这些研究人员猜测这是这种病毒的一个弱点,而且他们确实能够使用关闭蛋白产生的物质(即翻译抑制剂)来显著减少病毒复制。
在感染二十四小时后,SARS-CoV-2会导致宿主蛋白质组的组成发生明显变化:在胆固醇代谢减少的同时,碳水化合物代谢和作为蛋白前体的RNA修饰方面的活动增加了。基于此,这些研究人员通过使用这些过程的抑制剂,成功地阻止了这种病毒在体外细胞培养物中的增殖。使用一种抑制病毒基因组构成单元(building block,这里指碱基或者说核苷酸)产生的物质,也取得了类似的成功。
9.全文编译!养狗人士当心!我国香港大学研究人员发表Nature论文,指出狗也会被SARS-CoV-2感染
doi:10.1038/s41586-020-2334-5
当中国香港特别行政区确诊出任何人类COVID-19病例时,有关人士会被送到医院进行治疗,而被视为“密切接触者”的家庭接触者则会在指定的中心接受隔离。患上这种疾病的宠物主人可选择由香港渔农自然护理署(AFCD)照顾和隔离他们的猫和狗。从这些动物身上采集样本,以评估它们是否感染了SARS-CoV-2,并协助确定管理隔离中动物的最佳方法,包括选择把动物送还给它们的主人的时间。截至3月27日,已有15只狗和7只猫从已知有COVID-19病例的家庭中隔离并接受了测试。在此期间,来自中国香港大学的研究人员根据病毒学检测结果,发现两只狗已被SARS-CoV-2感染。相关研究结果于2020年5月14日在线发表在Nature期刊上,论文标题为“Infection of dogs with SARS-CoV-2”。
这些研究结果表明,这两只狗被SARS-CoV-2感染。已知ACE-2是这种病毒的进入受体,狗ACE-2与人类的ACE-2相似。在已知参与ACE-2与SARS-CoV-2刺突蛋白(S蛋白)受体结合域(RBD)之间相互作用的18个氨基酸中,有5个氨基酸在人与狗之间存在差异,但是这5个氨基酸中没有一个位于已知会破坏SARS-CoV RBD与ACE-2之间相互作用的区域。
有证据表明,SARS-CoV-2可以发生人与动物之间的传播。在这项新的研究中,这些研究人员没有关于这种病毒是否会在狗身上引起疾病的信息,但在这两只受感染的狗出现病毒脱落期间,在它们的身上都没有看到具体的临床体征。这只博美犬在结束隔离送还给主人的两天后死亡,这很可能是由于之前的基础疾病,但没有得到狗主人允许进行尸检的同意。被感染的狗是否会将这种病毒传染给其他动物或传回给人类,目前仍是未知数。这只德国牧羊犬的主人还饲养了第二只杂交狗,在第二只狗中既没有检测到病毒RNA,也没有检测到抗体反应,这说明这两只狗之间并没有发生病毒传播。
10.全文编译!我国香港大学揭示SARS-CoV-2在金黄地鼠中的发病机制和传播
doi:10.1038/s41586-020-2342-5
金黄地鼠(Golden Syrian hamster,也称叙利亚地鼠或黄金仓鼠)是一种广泛使用的实验动物模型,有报道称它们支持SARS-CoV复制,但不支持MERS-CoV复制,其中MERS-CoV利用二肽基肽酶-4(DPP4)蛋白作为病毒进入细胞的主要受体。先前对5周龄金黄地鼠进行的SARS-CoV(Urbani毒株)研究显示,这种病毒强劲地复制,在病毒接种两天后在肺部检测到的病毒滴度达到峰值,随后在病毒接种后七天内将这种病毒快速清除,但接种后的金黄地鼠没有体重下降或患病的证据。一项后续研究报告了对金黄地鼠进行不同SARS-CoV毒株的检测,发现不同SARS-CoV毒株之间的毒力存在差异;用Frk-1毒株接种的金黄地鼠出现了致死性,这种毒株与非致死的Urbani毒株的差异在于S蛋白的S2结构域发生了L1148F突变。地鼠容易被其他呼吸道病毒感染,包括人类偏肺病毒、人类副流感病毒3型和甲型流感病毒,并可能通过接触或空气传播途径促进流感传播。人类、猕猴、小鼠和地鼠的ACE2蛋白序列比对表明,SARS-CoV-2的S蛋白与地鼠ACE2的相互作用可能比小鼠ACE2更有效。
在一项新的研究中,来自中国香港大学的研究人员评估了SARS-CoV-2在4~5周龄的雄性金黄地鼠中的发病机制和接触传播性。相关研究结果于2020年5月14日在线发表在Nature期刊上,论文标题为“Pathogenesis and transmission of SARS-CoV-2 in golden hamsters”。
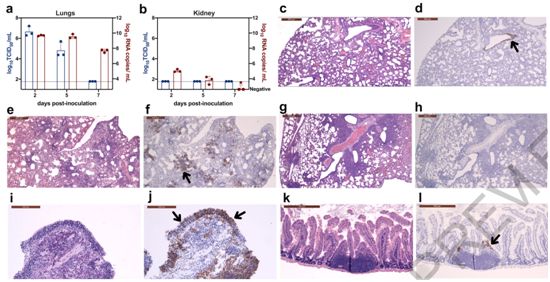
这些研究结果表明,金黄地鼠是SARS-CoV-2的合适实验动物模型,这种因为病毒接种的地鼠和自然感染的地鼠有明显的体重下降,并且有证据表明这种病毒在鼻粘膜和下呼吸道上皮细胞中可有效复制。SARS-CoV-2感染鼻粘膜嗅觉神经元的能力可能解释了在COVID-19患者中报告的嗅觉缺失。地鼠支持通过直接接触或通过气溶胶将SARS-CoV-2从病毒接种的供体地鼠向之前未接触过这种病毒的地鼠有效传播。
这些研究人员还发现,从供体地鼠到之前未接触过这种病毒的地鼠的传播可能在接种后早期的短时间内发生。这些研究结果与最近的一份报告一致,尽管这项新的研究还在同行评审中。地鼠很容易处理,并且存在用于支持疫苗开发的免疫学研究的试剂。
11.Nature重大进展:研究发展感染SARS-CoV-2的恒河猴呼吸系统疾病模型!
doi:10.1038/s41586-020-2324-7
为了在更接近人体的模型中揭示这种疾病的发病机制,来自美国国立卫生研究院过敏与传染病研究所病毒学实验室的研究人员近日在Nature上发文,揭示了受SARS-CoV-2感染的恒河猴出现呼吸系统疾病的过程及相关病理情况,该研究题为"Respiratory disease in rhesus macaques inoculated with SARS-CoV-2"。
研究人员发现SARS-CoV-2感染引起的呼吸系统疾病可以持续8-16天。研究人员通过肺部X光成像观察到了恒河猴出现的肺浸润,这是人类疾病的一个标志。他们在所有动物的鼻咽拭子和支气管肺泡灌洗液中均检测到高病毒载量。
综上所述,研究人员在恒河猴的COVID-19模型中观察到了在大多数人类病例中观察到的中度疾病。将恒河猴作为模式动物建立新型冠状病毒病模型,将加深我们对新型冠状病毒病发病机制的认识,并有助于医学对策的开发和试验。
12.Nature实锤了?科学家从马来亚穿山甲分离出SARS-CoV-2相关冠状病毒
doi:10.1038/s41586-020-2313-x
新冠肺炎疫情给全球健康带来前所未有的挑战。新型冠状病毒SARS-CoV-2与SARS-CoV以及蝙蝠冠状病毒RaTG132具有高序列同源性。虽然蝙蝠可能是各种冠状病毒的宿主,但SARS-CoV-2是否有其他宿主宿主仍不明确。
近日来自华南农业大学兽医学院、华南农业大学兽医学院、广州动物园、广东省野生动物救助中心、中国农业大学等单位的研究人员发现他们从一只马来亚穿山甲中分离得到的一种冠状病毒在E、M、N和S基因中分别与SARS-CoV-2的氨基酸同源性为100%、98.6%、97.8%和90.7%。特别是,穿山甲冠状病毒的S蛋白中的受体结合域与SARS-CoV-2的受体结合域几乎完全相同,只有一个非临界氨基酸的差异。相关研究成果于近日发表在Nature上,文章题为"Isolation of SARS-CoV-2-related coronavirus from Malayan pangolins"。
研究人员通过比较基因组分析发现,SARS-CoV-2可能源于类似于穿山甲冠状病毒的病毒与类似于蝙蝠冠状病毒RaTG132的病毒的重组。在分析的25种马来亚穿山甲中,研究人员在17种穿山甲体内发现了穿山甲病毒。他们发现被感染的穿山甲出现临床症状和组织学改变,其循环系统中的穿山甲冠状病毒抗体与SARS-CoV-2的S蛋白可以发生反应。
研究人员认为,在穿山甲中分离出一种与SARS-CoV-2高度相关的冠状病毒,表明它们有可能充当SARS-CoV-2的中间宿主。如果野生动物贸易得不到有效控制,这种新发现的冠状病毒可能会对公众健康构成威胁。
13.Nature:秦川等揭示SARS-CoV-2在hACE2转基因小鼠中的致病性
doi:10.1038/s41586-020-2312-y
考虑到血管紧张素转换酶2 (angiotensin- transferase 2, ACE2)是SARS-CoV5的细胞进入受体,来自中国医学科学院实验动物研究所的秦川团队与来自北京新发传染病动物模型重点实验室、北京协和医学院比较医学中心和国家病毒性疾病控制预防研究所等单位的合作团队利用携带人类ACE2并感染SARS-CoV-2的转基因小鼠来研究了病毒的致病性。相关研究成果近日发表在Nature上,题为"The pathogenicity of SARS-CoV-2 in hACE2 transgenic mice"。文章的共同通讯作者为中国医学科学院医学实验动物研究所秦川教授、中国疾病预防控制中心病毒病预防控制所武桂珍研究员。
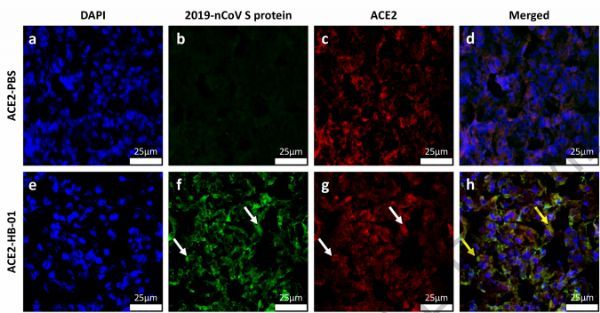
研究人员在感染SARS-CoV-2的hACE2小鼠中观察到体重下降和病毒在肺中的复制。研究人员发现典型的组织病理学表现为间质性肺炎,肺泡间质内可见明显的巨噬细胞和淋巴细胞浸润,肺泡腔内巨噬细胞聚集。他们在支气管上皮细胞、巨噬细胞和肺泡上皮细胞中均观察到病毒抗原。但是在感染SARS-CoV-2的野生型小鼠中未发现这种现象。
值得注意的是,研究人员证实了SARS-CoV-2在hACE2小鼠中的致病性。研究人员表示感染SARS-CoV-2的小鼠模型对于评估抗病毒治疗和疫苗以及了解COVID-19的发病机制具有重要意义。
14.突破!Nature快速重建SARS-CoV-2病毒!
doi:10.1038/s41586-020-2294-9
根据Nature杂志近日发表的一篇文章,研究人员已经利用啤酒酵母中的人工染色体产生出了新型冠状病毒全基因组的克隆。尽管其他实验室正在或者已经通过其他方法构建出了SARS-CoV-2的克隆,研究人员表示酵母系统的主要好处是它的速度和稳定性。
重建和修改致病病毒的基因组是许多病毒学研究的起点。这些基因操作对于研究病毒的感染方法、复制过程、可能对抗病毒的药物以及潜在的疫苗是至关重要的。
伯尔尼大学的共同作者Volker Thiel说:"我们的目的是了解这种病毒"及其弱点。就像世界各地从事此类研究的科学家一样,Thiel和他的团队在一个高防护设施中工作,该设施具有严格的生物安全和安全规程,旨在保护研究人员并防止任何病毒的意外释放。
可能最广泛使用的病毒基因组克隆方法是将DNA片段整合在一起,并将其引入大肠杆菌中进行复制。但是对于一些病毒,包括冠状病毒,这种方法可能会有问题。"首先,(冠状病毒)有非常大的基因组," Thiel说,这使得细菌很难完全负载它们,而且,基因组的某些部分是不稳定的,或者可能对细菌有毒,原因尚不完全清楚。
因为酵母细胞比细菌大,它们可以处理更大的DNA片段。同样来自伯尔尼大学的合着者Joerg Jores说,还有一个很大的优势。酵母细胞具有将DNA片段组装成一个大分子的固有能力。
Weiss说,这意味着,在将病毒DNA导入细胞之前,你不需要先重建病毒DNA,而是"将所有这些片段放入酵母中,然后神奇地将它们组合在一起"。
此自动片段组装是前面描述的克隆方法的核心,该方法称为转换关联重组(transformation associated recombination, TAR)。为了重建SARS-CoV-2, Thiel、Jores和同事生成了代表整个病毒基因组的14个DNA片段(有些是从病毒RNA扩增而来,有些是合成的)。每个片段与下一个片段共享一个重叠的短区域,这样酵母细胞就可以识别出哪一个末端是匹配的。基因组的两端片段还与一个质粒载体共享重叠序列,该质粒载体将包含病毒基因组并允许其形成酵母人工染色体(YAC)。这种粘合过程被称为同源重组,它包括将一条DNA链末端的核苷酸修剪掉,并将剩余的互补序列(重叠部分)退火与另一个片段结合。
他的团队将这些片段导入酿酒酵母的细胞中,并在两天后挑选并测试菌落是否存在完整的基因组。从这些克隆体中提取的DNA在体外转录,然后产生RNA,用于感染培养的哺乳动物细胞。从将DNA导入酵母到恢复传染性RNA病毒只用了一周时间。他们说,研究小组还克隆了一个编码荧光报告基因的SARS-CoV-2版本,用于高通量药物筛选。(生物谷 Bioon.com)

SARS-CoV-2(之前称为2019-nCoV)的透射电镜图,图片来自NIAID RML。
2020年2月11日,世卫组织将这种疾病病重命名为2019年冠状病毒病(COVID-19)。同一天,负责分类和命名病毒的的国际病毒分类学委员会的冠状病毒研究小组在bioRxiv上发表了一篇文章,指出该研究小组已经决定,新型冠状病毒2019-nCoV是导致2002-2003年爆发严重急性呼吸综合征(SARS)冠状病毒(SARS-CoV)的变种。因此,将这种新病原体重新命名为严重急性呼吸综合征冠状病毒2号(severe acute respiratory syndrome coronavirus 2),或SARS-CoV-2。值得注意的一点是,尽管国际病毒分类委员会冠状病毒研究小组将病毒命名为SARS-CoV-2,但该研究小组主席John Ziebuhr认为这个名字(SARS-CoV-2)和SARS(严重急性呼吸综合征,也称非典型肺炎)没有关联。不过,这种病毒的重新命名引起了不少争议。据《科学》网站报道,世界卫生组织不满意SARS-CoV-2这个名字,而且不打算采用此名称。
冠状病毒可引起多种动物的多系统感染。在此之前已有6种冠状病毒可以感染人类,它们主要引起人类的呼吸道感染:两种高度致命性的冠状病毒,即严重急性呼吸道综合征(SARS)冠状病毒(SARS-CoV)和中东呼吸综合征(MERS)冠状病毒(MERS-CoV);4种可导致温和的上呼吸道疾病的冠状病毒,即HCoV-OC43、HCoV-229E、HCoV-NL63和HCoV-HKU1。
基于此次疫情给中国和全世界带来严重的危害,小编针对Nature期刊上发表的2019-nCoV/COVID-19研究进行一番梳理,以飨读者。
1.Nature:COVID-19康复者对SARS-CoV-2的抗体反应
doi:10.1038/s41586-020-2456-9
在COVID-19大流行期间,SARS-CoV-2感染了数百万人,夺去了数十万人的生命。病毒进入宿主细胞取决于SARS-CoV-2刺突蛋白(S)的受体结合结构域(RBD)。虽然没有疫苗,但抗体很可能是保护的关键。然而,对SARS-CoV-2的人类抗体反应知之甚少。在一项新的研究中,Davide F. Robbiani等人报告了149名COVID-19康复者。在症状发生平均39天后收集到的血浆具有不同的半数最大假病毒中和滴度(half-maximal pseudovirus neutralizing titre):33%的人小于1:50,79%的人低于1:1000,而只有1%的人显示滴度高于1:5000。抗体测序显示在不同个体中表达密切相关抗体的RBD特异性记忆B细胞的扩增克隆。尽管血浆滴度较低,但RBD上三个不同表位的抗体中和的半数最大抑制浓度(IC50值)低至个位数纳克/毫升。因此,从COVID-19康复者身上获得的大多数康复期血浆不含有高水平的中和活性。然而,在所有被测试的人中都发现了罕见但反复出现的具有强大抗病毒活性的RBD特异性抗体,这表明为引起这类抗体而设计的疫苗可能广泛有效。
2.Nature:重大发现!一种人类抗体可以强效中和包括SARS-CoV和SARS-CoV-2在内的多种冠状病毒
doi:10.1038/s41586-020-2349-y
在一项新的研究中,来自瑞士Humabs生物医学公司(Humabs Biomed SA)和美国华盛顿大学的研究人员发现在2003年从一名严重急性呼吸综合征(SARS,俗称非典型肺炎)患者的血液样本中首次鉴定出的一种抗体可抑制相关的冠状病毒,包括导致2019年冠状病毒病(COVID-19)的新型冠状病毒SARS-CoV-2。这种称为S309的抗体目前在Vir生物技术公司(下称Vir公司)已进入快速开发和测试轨道,下一步可能进行临床试验。相关研究结果于2020年5月18日在线发表在Nature期刊上,论文标题为“Cross-neutralization of SARS-CoV and SARS-CoV2 by a human monoclonal antibody”。论文通讯作者为华盛顿大学医学院生物化学助理教授David Veesler和Vir子公司Humabs生物医学公司的Davide Corti。论文第一作者为Humabs生物医学公司的Dora Pinto和Martina Beltramello,以及Veesler实验室的Young-Jun Park和Lexi Walls。这四名论文第一作者多年来一直在研究多种冠状病毒的感染性复合物的结构和功能。

SARS-CoV-2刺突蛋白与S309的mAb Fab片段形成的复合物的低温电镜结构,图片来自Nature, 2020, doi:10.1038/s41586-020-2349-y。
通过低温电镜研究和结合测试实验,这些研究人员了解到S309抗体识别冠状病毒表面上的一个结合位点,这个结合位点在β冠状病毒属sarbocovirus亚属的许多病毒中都是保守的,而不仅仅是在SARS-CoV(导致SARS的冠状病毒)和SARS-CoV-2病毒中是保守的。这大概就是为什么这种抗体不是仅对一种冠状病毒而是对多种相关的冠状病毒起作用。将S309抗体与康复后的SARS患者中发现的其他较弱的抗体相结合,可增强对SARS-CoV-2病毒的中和作用。
3.Nature重大进展!瑞德西韦对感染SARS-CoV-2的恒河猴有效!
doi:10.1038/s41586-020-2423-5
瑞德西韦(Remdesivir, GS-5734)是一种核苷酸模拟前药,具有广泛的抗病毒活性,目前正在COVID-19临床试验中进行研究,最近获得了美国食品和药物管理局的紧急使用授权。在动物模型中,瑞德西韦治疗对MERS-CoV和SARS-CoV感染是有效的。在体外实验中,瑞德西韦抑制了SARS-CoV-2的复制。
近日来自国立卫生研究院国立过敏和传染病研究所的研究人员研究了瑞德西韦在治疗恒河猴SARS-CoV-2感染模型中的疗效,相关研究成果近日发表在Nature上,题为"Clinical benefit of remdesivir in rhesus macaques infected with SARS-CoV-2"。
研究人员发现,与空白治疗的动物相比,第一次给药12小时后,接受瑞德西韦治疗的动物没有表现出呼吸系统疾病的迹象,x光片显示肺部浸润减少,支气管肺泡灌洗中病毒滴度降低。但是,瑞德西韦治疗未减少上呼吸道病毒脱落。牺牲动物后进行尸检发现,瑞德西韦治疗的动物的肺病毒载量较低,对肺的损害也有所减少。因此,在感染早期开始瑞德西韦治疗对感染SARS-CoV-2的恒河猴有临床疗效。
4.Nature:11个欧洲国家阻止SARS-CoV-2传播的封锁措施避免了300多万人死亡
doi:10.1038/s41586-020-2405-7
根据一项新的模型研究,随着大多数国家都在采取严格措施阻止新冠病毒(SARS-CoV-2)的传播,封锁防止了11个欧洲国家大约310万人的死亡。相关研究结果于2020年6月8日在线发表在Nature期刊上,论文标题为“Estimating the effects of non-pharmaceutical interventions on COVID-19 in Europe”。

欧洲采取的封锁措施避免的COVID-19死亡人数。图片来自Nature, 2020, doi:10.1038/s41586-020-2405-7。
正在就这种冠状病毒向英国政府提供建议的英国帝国理工学院科学家们发现,诸如禁止外出等限制措施对控制疫情起到了作用。通过使用欧洲疾病控制中心提供的截至5月4日11个欧洲国家的死亡数据,他们发现将在这些国家观察到的死亡人数与他们的模型所预测的在没有实施限制措施时的死亡人数进行了比较。他们估计,这些政策避免了大约310万人的死亡。
这些研究人员还计算出,这些干预措施导致了再生数(reproduction number)---一个感染者可以感染的人数---平均下降了82%,降至1.0以下。
这些研究人员说,“我们的结果表明主要的非药物干预措施,特别是封锁,对减少传播有很大的影响。应该考虑继续进行干预,以控制SARS-CoV-2的传播。”
这些研究人员估计,在此期间累计有1200万至1500万人被感染---或者说占这11个欧洲国家人口的3.2%至4%。感染人数在各国之间波动很大,德国只有71万人被认为感染了这种冠状病毒,占德国人口的0.85%。相比之下,比利时的感染率最高,占比利时人口的8%,而西班牙则有大约5.5%的人口,即260万人,被认为感染了这种冠状病毒。
5.两篇Nature重大进展!中国科学家从病人体内分离出SARS-CoV-2特异性的中和性抗体!
doi:10.1038/s41586-020-2381-y; doi:10.1038/s41586-020-2380-z
由SARS-CoV-2引起的2019冠状病毒病(COVID-19)在全球暴发,是目前的全球卫生紧急事件,急需治疗性药物以及预防性疫苗缓解疫情。抗体是治疗COVID-19的有效药物之一,目前已有不少临床试验正在使用恢复的病人的血清进行治疗,但是这种方法难以批量生产,同时病人血清中的抗体数量繁多,特异性不确定,因此效果如何未可知。所以从这些康复的病人体内找出SARS-CoV-2特异性的中和性抗体对于下一步的治疗性抗体的开发和批量生产至关重要。5月26日,Nature杂志同时上线了两篇中国科学家完成的最新研究,分别从病人体内分离出了SARS-CoV-2特异性的高活性中和性抗体。
其中一项研究题为"A human neutralizing antibody targets the receptor binding site of SARS-CoV-2",由中国科学院微生物研究所的严景华团队、高福团队、王奇慧团队与中科院武汉病毒所、国家疾病预防控制中心病毒病研究所、北京地坛医院等机构合作完成。在该研究中,研究人员报告了从一名恢复期COVID-19患者中分离出2种特异性人类单克隆抗体(MAbs):CA1和CB6。
研究人员发现CA1和CB6在体外对SARS-CoV-2表现出了强大的SARS-CoV-2特异性的中和活性。此外,在预防和治疗环境中,CB6都能抑制恒河猴的SARS-CoV-2感染。进一步的结构研究表明,CB6可以识别与SARS-CoV-2受体结合域(RBD)中的血管紧张素转换酶2 (ACE2)结合位点重叠的表位,从而通过空间位阻和直接的界面-残基竞争作用干扰病毒/受体的相互作用。这些研究结果表明,CB6值得进一步的临床研究和转化。
另一项研究题为"Human neutralizing antibodies elicited by SARS-CoV-2 infection",由清华大学医学院张林琦团队和国家感染性疾病临床医学研究中心张政团队及清华大学生命科学学院和结构生物学高精尖创新中心王新泉团队合作完成。
SARS-CoV-2进入靶细胞依赖于病毒刺突蛋白的受体结合域(RBD)和ACE2细胞受体之间的结合。在这项研究中,研究人员报告了从8例SARS-CoV-2感染者的单个B细胞中分离并鉴定206个RBD特异性单克隆抗体。研究人员鉴定了具有有效的抗SARS-CoV-2中和活性的抗体,这些抗体与ACE2结合RBD的竞争能力相关。
令人惊讶的是,尽管发现了大量的针对其三聚刺突蛋白的血浆交叉反应,但无论是抗SARS-CoV-2抗体,还是感染的血浆与SARS-CoV或MERS-CoV RBDs都没有发生交叉反应。RBD结合抗体的晶体结构分析显示空间位阻可以抑制病毒与ACE2的结合,从而阻断病毒的进入。这些发现表明,抗RBD抗体是病毒种特异性抑制剂。这里发现的抗体可能是开发SARS-CoV-2临床干预的候选抗体。
6.Nature突破!揭示SARS-CoV-2复制遗传物质的机制!
doi:10.1038/s41586-020-2368-8
当一个人被新型冠状病毒SARS-CoV-2感染时,病原体在感染者的细胞内迅速增殖。要做到这一点,病毒必须繁殖它的遗传物质,它是由一条长长的RNA链组成的。这个过程是由病毒"复印机"--即所谓的聚合酶来完成的。德国哥廷根马克斯普朗克生物物理化学研究所的Patrick Cramer领导的研究人员现在已经确定了冠状聚合酶的三维结构。这使得现在有可能研究抗病毒药物如瑞德西韦(一种阻断聚合酶的药物)是如何起作用的,并寻找新的抑制物质。
了解冠状病毒聚合酶是如何在原子尺度上构建的,为更好地理解和对抗病原体开辟了新的可能性。下一步,Cramer的团队将详细研究抗病毒物质是如何阻止冠状病毒扩散的。Cramer说"许多希望寄托在直接阻断聚合酶的药物瑞德西韦上。有了这种结构,就有可能优化现有物质,如瑞德西韦等药物,并改善其效果。但我们也想寻找能够阻止病毒聚合酶的新物质。"
7.全文编译!我国科学发表Nature论文,揭示与COVID-19患者临床结果相关的病毒和宿主因素
doi:10.1038/s41586-020-2355-0
目前,关于SARS-CoV-2的起源、进化及其与宿主之间的相互作用仍存在几个问题。首先,尽管HSWM市场被广泛认为是SARS-CoV-2的原始疫情爆发地点,但是在最初的一系列病例中,相当多的病例并没有接触这个市场。这使得人们对最初的疫情爆发时,人畜共患病溢出到人类中的单一事件产生了怀疑。第二,SARS-CoV-2的毒力是否由于疾病传播过程中的基因组序列进化而发生了改变,还有待更多的数据来回答。第三,虽然SARS-CoV-2感染可引起危及生命的呼吸系统疾病,但大多数病例表现为轻度肺炎。迄今为止,与疾病临床结果相关的因素尚未充分描述。
在一项新的研究中,来自中国复旦大学、上海交通大学医学院和中国科学院上海生命科学研究院的研究人员系统地分析了贯穿整个感染过程中的关键免疫学参数,直接从临床样本中获得病毒基因组,并确定了与疾病临床结果和流行病学特征相关的因素。相关研究结果于2020年5月20日在线发表在Nature期刊上,论文标题为“Viral and host factors related to the clinical outcome of COVID-19”。

对组装的SARS-CoV-2基因组的系统发育分析。
通过密切监测326例COVID-19患者的分子和免疫学数据,这些作者提出不良的临床结果与CD3+ T淋巴细胞衰竭有关,这种衰竭与IL-6和IL-8等细胞因子的急剧增加密切相关。针对1月下旬至2月期间感染的94例病例的靶向测序结果发现这种病毒基因组中的有限变异提示着稳定的进化。来自同一祖先的两个主要病毒谱系可能于2019年12月在武汉独立进化,尽管在临床表现或传播性方面没有发现它们之间存在重大差异。这些数据为揭示病毒和宿主因素在疾病机制中各自发挥的作用提供了进一步的证据,并强调了早期干预治疗的重要性。
8.Nature:新研究揭示潜在的COVID-19治疗靶点
doi:10.1038/s41586-020-2332-7
在一项新的研究中,来自德国歌德大学和法兰克福大学医院的研究人员能够观察到人体细胞在感染SARS-CoV-2---导致人类患上2019年冠状病毒病(COVID-19)的新型冠状病毒---后的变化。他们在实验室模型中测试了一系列化合物,发现了其中的一些化合物可延缓或阻止病毒复制。这些结果如今能够将寻找活性物质的范围缩小到少数已被批准上市的药物上。根据这些发现,一家美国公司报道它正在准备开战临床试验。一家加拿大公司也利用一种不同的活性物质开始了临床研究。相关研究结果于2020年5月14日在线发表在Nature期刊上,论文标题为“Proteomics of SARS-CoV-2-infected host cells reveals therapy targets”。
利用在歌德大学第二生物化学研究所开发的一项技术,来自这两个研究机构的研究人员共同展示了SARS-CoV-2感染是如何改变人类宿主细胞的。他们使用了他们在几个月前开发出的一种特殊形式的质谱法(称为mePROD方法)。这种方法可以测定细胞内成千上万种蛋白的数量和合成率。
这些研究结果描绘了SARS-CoV-2感染的发展过程:尽管许多病毒为了有利于自身病毒蛋白的产生而关闭了宿主的蛋白产生,但是SARS-CoV-2只对宿主细胞的蛋白产生产生轻微的影响,病毒蛋白似乎是在与宿主细胞蛋白的竞争中产生的。相反,SARS-CoV-2感染导致细胞内的蛋白合成复合物增加。这些研究人员猜测这是这种病毒的一个弱点,而且他们确实能够使用关闭蛋白产生的物质(即翻译抑制剂)来显著减少病毒复制。
在感染二十四小时后,SARS-CoV-2会导致宿主蛋白质组的组成发生明显变化:在胆固醇代谢减少的同时,碳水化合物代谢和作为蛋白前体的RNA修饰方面的活动增加了。基于此,这些研究人员通过使用这些过程的抑制剂,成功地阻止了这种病毒在体外细胞培养物中的增殖。使用一种抑制病毒基因组构成单元(building block,这里指碱基或者说核苷酸)产生的物质,也取得了类似的成功。
9.全文编译!养狗人士当心!我国香港大学研究人员发表Nature论文,指出狗也会被SARS-CoV-2感染
doi:10.1038/s41586-020-2334-5
当中国香港特别行政区确诊出任何人类COVID-19病例时,有关人士会被送到医院进行治疗,而被视为“密切接触者”的家庭接触者则会在指定的中心接受隔离。患上这种疾病的宠物主人可选择由香港渔农自然护理署(AFCD)照顾和隔离他们的猫和狗。从这些动物身上采集样本,以评估它们是否感染了SARS-CoV-2,并协助确定管理隔离中动物的最佳方法,包括选择把动物送还给它们的主人的时间。截至3月27日,已有15只狗和7只猫从已知有COVID-19病例的家庭中隔离并接受了测试。在此期间,来自中国香港大学的研究人员根据病毒学检测结果,发现两只狗已被SARS-CoV-2感染。相关研究结果于2020年5月14日在线发表在Nature期刊上,论文标题为“Infection of dogs with SARS-CoV-2”。
这些研究结果表明,这两只狗被SARS-CoV-2感染。已知ACE-2是这种病毒的进入受体,狗ACE-2与人类的ACE-2相似。在已知参与ACE-2与SARS-CoV-2刺突蛋白(S蛋白)受体结合域(RBD)之间相互作用的18个氨基酸中,有5个氨基酸在人与狗之间存在差异,但是这5个氨基酸中没有一个位于已知会破坏SARS-CoV RBD与ACE-2之间相互作用的区域。
有证据表明,SARS-CoV-2可以发生人与动物之间的传播。在这项新的研究中,这些研究人员没有关于这种病毒是否会在狗身上引起疾病的信息,但在这两只受感染的狗出现病毒脱落期间,在它们的身上都没有看到具体的临床体征。这只博美犬在结束隔离送还给主人的两天后死亡,这很可能是由于之前的基础疾病,但没有得到狗主人允许进行尸检的同意。被感染的狗是否会将这种病毒传染给其他动物或传回给人类,目前仍是未知数。这只德国牧羊犬的主人还饲养了第二只杂交狗,在第二只狗中既没有检测到病毒RNA,也没有检测到抗体反应,这说明这两只狗之间并没有发生病毒传播。
10.全文编译!我国香港大学揭示SARS-CoV-2在金黄地鼠中的发病机制和传播
doi:10.1038/s41586-020-2342-5
金黄地鼠(Golden Syrian hamster,也称叙利亚地鼠或黄金仓鼠)是一种广泛使用的实验动物模型,有报道称它们支持SARS-CoV复制,但不支持MERS-CoV复制,其中MERS-CoV利用二肽基肽酶-4(DPP4)蛋白作为病毒进入细胞的主要受体。先前对5周龄金黄地鼠进行的SARS-CoV(Urbani毒株)研究显示,这种病毒强劲地复制,在病毒接种两天后在肺部检测到的病毒滴度达到峰值,随后在病毒接种后七天内将这种病毒快速清除,但接种后的金黄地鼠没有体重下降或患病的证据。一项后续研究报告了对金黄地鼠进行不同SARS-CoV毒株的检测,发现不同SARS-CoV毒株之间的毒力存在差异;用Frk-1毒株接种的金黄地鼠出现了致死性,这种毒株与非致死的Urbani毒株的差异在于S蛋白的S2结构域发生了L1148F突变。地鼠容易被其他呼吸道病毒感染,包括人类偏肺病毒、人类副流感病毒3型和甲型流感病毒,并可能通过接触或空气传播途径促进流感传播。人类、猕猴、小鼠和地鼠的ACE2蛋白序列比对表明,SARS-CoV-2的S蛋白与地鼠ACE2的相互作用可能比小鼠ACE2更有效。
在一项新的研究中,来自中国香港大学的研究人员评估了SARS-CoV-2在4~5周龄的雄性金黄地鼠中的发病机制和接触传播性。相关研究结果于2020年5月14日在线发表在Nature期刊上,论文标题为“Pathogenesis and transmission of SARS-CoV-2 in golden hamsters”。

金黄色地鼠鼻内感染SARS-CoV-2后的病毒载量和组织病理学变化。
这些研究结果表明,金黄地鼠是SARS-CoV-2的合适实验动物模型,这种因为病毒接种的地鼠和自然感染的地鼠有明显的体重下降,并且有证据表明这种病毒在鼻粘膜和下呼吸道上皮细胞中可有效复制。SARS-CoV-2感染鼻粘膜嗅觉神经元的能力可能解释了在COVID-19患者中报告的嗅觉缺失。地鼠支持通过直接接触或通过气溶胶将SARS-CoV-2从病毒接种的供体地鼠向之前未接触过这种病毒的地鼠有效传播。
这些研究人员还发现,从供体地鼠到之前未接触过这种病毒的地鼠的传播可能在接种后早期的短时间内发生。这些研究结果与最近的一份报告一致,尽管这项新的研究还在同行评审中。地鼠很容易处理,并且存在用于支持疫苗开发的免疫学研究的试剂。
11.Nature重大进展:研究发展感染SARS-CoV-2的恒河猴呼吸系统疾病模型!
doi:10.1038/s41586-020-2324-7
为了在更接近人体的模型中揭示这种疾病的发病机制,来自美国国立卫生研究院过敏与传染病研究所病毒学实验室的研究人员近日在Nature上发文,揭示了受SARS-CoV-2感染的恒河猴出现呼吸系统疾病的过程及相关病理情况,该研究题为"Respiratory disease in rhesus macaques inoculated with SARS-CoV-2"。
研究人员发现SARS-CoV-2感染引起的呼吸系统疾病可以持续8-16天。研究人员通过肺部X光成像观察到了恒河猴出现的肺浸润,这是人类疾病的一个标志。他们在所有动物的鼻咽拭子和支气管肺泡灌洗液中均检测到高病毒载量。
综上所述,研究人员在恒河猴的COVID-19模型中观察到了在大多数人类病例中观察到的中度疾病。将恒河猴作为模式动物建立新型冠状病毒病模型,将加深我们对新型冠状病毒病发病机制的认识,并有助于医学对策的开发和试验。
12.Nature实锤了?科学家从马来亚穿山甲分离出SARS-CoV-2相关冠状病毒
doi:10.1038/s41586-020-2313-x
新冠肺炎疫情给全球健康带来前所未有的挑战。新型冠状病毒SARS-CoV-2与SARS-CoV以及蝙蝠冠状病毒RaTG132具有高序列同源性。虽然蝙蝠可能是各种冠状病毒的宿主,但SARS-CoV-2是否有其他宿主宿主仍不明确。
近日来自华南农业大学兽医学院、华南农业大学兽医学院、广州动物园、广东省野生动物救助中心、中国农业大学等单位的研究人员发现他们从一只马来亚穿山甲中分离得到的一种冠状病毒在E、M、N和S基因中分别与SARS-CoV-2的氨基酸同源性为100%、98.6%、97.8%和90.7%。特别是,穿山甲冠状病毒的S蛋白中的受体结合域与SARS-CoV-2的受体结合域几乎完全相同,只有一个非临界氨基酸的差异。相关研究成果于近日发表在Nature上,文章题为"Isolation of SARS-CoV-2-related coronavirus from Malayan pangolins"。
研究人员通过比较基因组分析发现,SARS-CoV-2可能源于类似于穿山甲冠状病毒的病毒与类似于蝙蝠冠状病毒RaTG132的病毒的重组。在分析的25种马来亚穿山甲中,研究人员在17种穿山甲体内发现了穿山甲病毒。他们发现被感染的穿山甲出现临床症状和组织学改变,其循环系统中的穿山甲冠状病毒抗体与SARS-CoV-2的S蛋白可以发生反应。
研究人员认为,在穿山甲中分离出一种与SARS-CoV-2高度相关的冠状病毒,表明它们有可能充当SARS-CoV-2的中间宿主。如果野生动物贸易得不到有效控制,这种新发现的冠状病毒可能会对公众健康构成威胁。
13.Nature:秦川等揭示SARS-CoV-2在hACE2转基因小鼠中的致病性
doi:10.1038/s41586-020-2312-y
考虑到血管紧张素转换酶2 (angiotensin- transferase 2, ACE2)是SARS-CoV5的细胞进入受体,来自中国医学科学院实验动物研究所的秦川团队与来自北京新发传染病动物模型重点实验室、北京协和医学院比较医学中心和国家病毒性疾病控制预防研究所等单位的合作团队利用携带人类ACE2并感染SARS-CoV-2的转基因小鼠来研究了病毒的致病性。相关研究成果近日发表在Nature上,题为"The pathogenicity of SARS-CoV-2 in hACE2 transgenic mice"。文章的共同通讯作者为中国医学科学院医学实验动物研究所秦川教授、中国疾病预防控制中心病毒病预防控制所武桂珍研究员。

图片来源:Nature。
研究人员在感染SARS-CoV-2的hACE2小鼠中观察到体重下降和病毒在肺中的复制。研究人员发现典型的组织病理学表现为间质性肺炎,肺泡间质内可见明显的巨噬细胞和淋巴细胞浸润,肺泡腔内巨噬细胞聚集。他们在支气管上皮细胞、巨噬细胞和肺泡上皮细胞中均观察到病毒抗原。但是在感染SARS-CoV-2的野生型小鼠中未发现这种现象。
值得注意的是,研究人员证实了SARS-CoV-2在hACE2小鼠中的致病性。研究人员表示感染SARS-CoV-2的小鼠模型对于评估抗病毒治疗和疫苗以及了解COVID-19的发病机制具有重要意义。
14.突破!Nature快速重建SARS-CoV-2病毒!
doi:10.1038/s41586-020-2294-9
根据Nature杂志近日发表的一篇文章,研究人员已经利用啤酒酵母中的人工染色体产生出了新型冠状病毒全基因组的克隆。尽管其他实验室正在或者已经通过其他方法构建出了SARS-CoV-2的克隆,研究人员表示酵母系统的主要好处是它的速度和稳定性。
重建和修改致病病毒的基因组是许多病毒学研究的起点。这些基因操作对于研究病毒的感染方法、复制过程、可能对抗病毒的药物以及潜在的疫苗是至关重要的。
伯尔尼大学的共同作者Volker Thiel说:"我们的目的是了解这种病毒"及其弱点。就像世界各地从事此类研究的科学家一样,Thiel和他的团队在一个高防护设施中工作,该设施具有严格的生物安全和安全规程,旨在保护研究人员并防止任何病毒的意外释放。
可能最广泛使用的病毒基因组克隆方法是将DNA片段整合在一起,并将其引入大肠杆菌中进行复制。但是对于一些病毒,包括冠状病毒,这种方法可能会有问题。"首先,(冠状病毒)有非常大的基因组," Thiel说,这使得细菌很难完全负载它们,而且,基因组的某些部分是不稳定的,或者可能对细菌有毒,原因尚不完全清楚。
因为酵母细胞比细菌大,它们可以处理更大的DNA片段。同样来自伯尔尼大学的合着者Joerg Jores说,还有一个很大的优势。酵母细胞具有将DNA片段组装成一个大分子的固有能力。
Weiss说,这意味着,在将病毒DNA导入细胞之前,你不需要先重建病毒DNA,而是"将所有这些片段放入酵母中,然后神奇地将它们组合在一起"。
此自动片段组装是前面描述的克隆方法的核心,该方法称为转换关联重组(transformation associated recombination, TAR)。为了重建SARS-CoV-2, Thiel、Jores和同事生成了代表整个病毒基因组的14个DNA片段(有些是从病毒RNA扩增而来,有些是合成的)。每个片段与下一个片段共享一个重叠的短区域,这样酵母细胞就可以识别出哪一个末端是匹配的。基因组的两端片段还与一个质粒载体共享重叠序列,该质粒载体将包含病毒基因组并允许其形成酵母人工染色体(YAC)。这种粘合过程被称为同源重组,它包括将一条DNA链末端的核苷酸修剪掉,并将剩余的互补序列(重叠部分)退火与另一个片段结合。
他的团队将这些片段导入酿酒酵母的细胞中,并在两天后挑选并测试菌落是否存在完整的基因组。从这些克隆体中提取的DNA在体外转录,然后产生RNA,用于感染培养的哺乳动物细胞。从将DNA导入酵母到恢复传染性RNA病毒只用了一周时间。他们说,研究小组还克隆了一个编码荧光报告基因的SARS-CoV-2版本,用于高通量药物筛选。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


