克罗恩病治疗新希望!Clin Transl Med:脂肪干细胞胞外囊泡助力改善淋巴功能、抑制炎症
来源:生物谷原创 2024-12-31 09:28
研究表明,源自脂肪干细胞的细胞外囊泡(CrF-EVs)可通过miR-132-3p/RASA1/ERK1/2轴改善克罗恩病(CD)小鼠模型的淋巴功能,减轻结肠和肠系膜炎症。

克罗恩病(Crohn’s disease,CD)是一种慢性、复发性的胃肠道疾病,其炎症会累及整个肠壁及周围结构,如肠系膜。肠系膜脂肪包裹增厚(creeping fat,CrF)是CD的一个典型特征,但一直以来,人们对CrF在疾病发展过程中的作用存在争议。尽管如此,越来越多的研究表明,CrF可能在CD的进展中发挥着保护作用。脂肪组织中的脂肪干细胞(adipose tissue-derived stem cells,ADSCs)是一类具有重要调节功能的细胞,它们能够通过释放细胞外囊泡与周围细胞进行通讯,从而调节炎症反应。然而,来源于CrF中的ADSCs所分泌的EVs(CrF-EVs)在CD中的具体调节作用仍然有待深入探索。
最近,一项发表于Clin Transl Med的研究Extracellular vesicles derived from creeping fat stem cells promote lymphatic function and restrain inflammation of Crohn's disease发现,来源于CrF脂肪组织干细胞的细胞外囊泡(extracellular vesicles,EVs)在改善CD淋巴功能及抑制炎症方面具有巨大潜力,为CD治疗带来了新的方向。

CrF-EVs在小鼠体内的分布与定位
研究人员从CD患者的CrF和正常MAT中成功分离并培养ADSCs,通过流式细胞术检测到其表达CD90、CD44、CD29等间充质阳性标志物,不表达CD45阴性标志物,同时油红O染色证实了其脂肪分化潜能。对ADSCs分泌的EVs进行表征分析,透射电子显微镜显示CrF-EVs和Ctrl-EVs具有典型形态,Westernblot检测到EV标志物的表达,纳米颗粒跟踪分析表明其大小在100-200 nm之间。将DiR荧光标记的EVs尾静脉注射到Il-10-/-小鼠体内,12小时后荧光显微镜观察发现,CrF-EVs和Ctrl-EVs均能有效定位于小鼠结肠和肠系膜,这为后续研究其功能奠定了基础。
CrF-EVs对小鼠结肠炎和肠系膜炎症的缓解作用
Il-10-/-小鼠从15周龄开始出现明显的结肠和肠系膜炎症,19周时体重减轻、结肠缩短,内镜下可见结肠壁增厚、血管模式改变,内镜和组织学评分升高。CrF-EVs治疗4周后,可显著改善这些症状,使小鼠体重减轻趋势减缓、结肠长度恢复、炎症评分降低。同时,CrF-EVs还能逆转Il-10-/-小鼠肠系膜肥大的现象,使肠系膜重量与体重比值恢复正常,且治疗后的肠系膜脂肪细胞变小,呈现出脂肪“褐变”的特征,这一过程被认为具有抗炎作用。此外,CrF-EVs可减少结肠和肠系膜中CD4+ T细胞和F4/80+巨噬细胞的浸润,降低血清和组织中TNF-α、IL-1β、IL-6等促炎因子水平,表明CrF-EVs能有效抑制炎症反应。
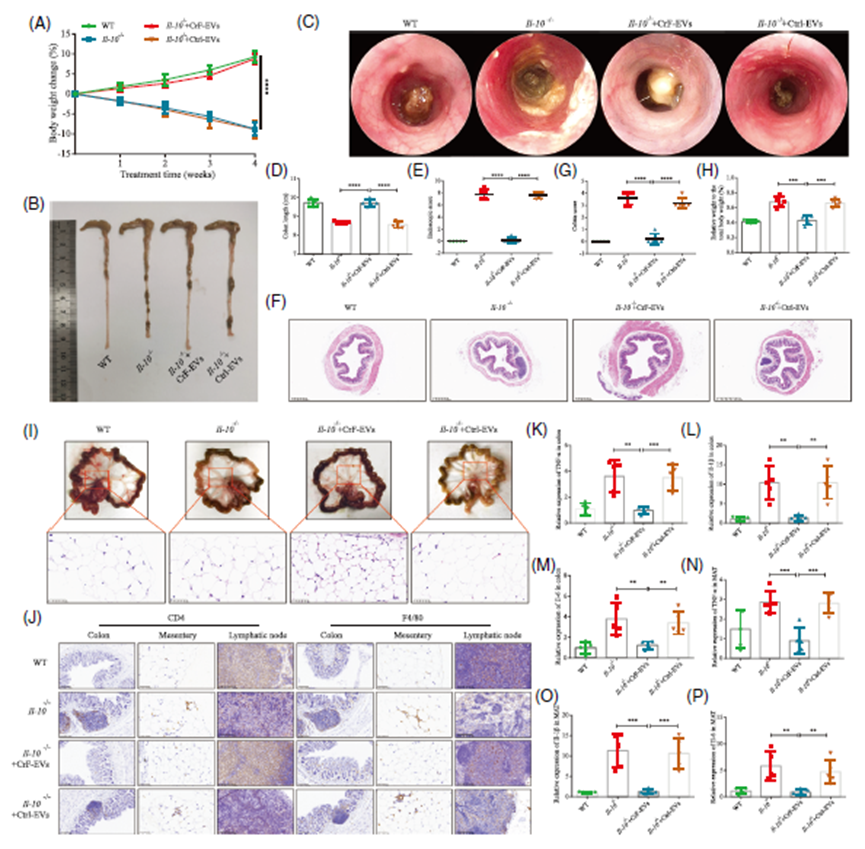
图1. CrF-EVs可减轻Il-10-/-小鼠的自发性结肠炎和肠系膜炎症
CrF-EVs对淋巴引流和淋巴内皮细胞功能的增强作用
鉴于Il-10-/-小鼠存在淋巴管功能障碍,研究人员假设改善肠系膜淋巴功能可缓解炎症。通过实验发现,CrF-EVs治疗后,小鼠结肠和肠系膜的淋巴管密度显著增加,表明其促进了淋巴管生成。在淋巴引流功能检测中,口服Bodipy FL-C16荧光脂质示踪剂后,CrF-EV治疗组小鼠肠系膜淋巴引流明显增强;直肠黏膜下注射Evansblue染料后,该组小鼠远端直肠染料残留减少,进一步证实CrF-EVs可促进淋巴引流。体外实验表明,HLECs能摄取CrF-EVs,摄取后其增殖、迁移和管形成能力显著增强,同时CCL21分泌增加,而皮下脂肪组织来源的ADSCs分泌的EVs(SAT-EVs)对淋巴功能无明显影响,突出了CrF-EVs对淋巴内皮细胞功能的特异性调节作用。
CrF-EVs通过miR-132-3p发挥作用的机制
为探究CrF-EVs调节淋巴功能的分子机制,研究人员进行了miRNA高通量测序,发现CrF-EVs中有多个miRNAs表达发生改变,其中miR-132-3p在CrF-EVs中的表达显著高于Ctrl-EVs,且在CrF-ADSCs和HLECs中也高表达。抑制CrF-EVs中的miR-132-3p可削弱其对HLECs增殖、迁移、管形成和CCL21分泌的促进作用,而过表达miR-132-3p则能增强HLECs的这些功能,证实CrF-EVs通过传递miR-132-3p调节淋巴内皮细胞功能。
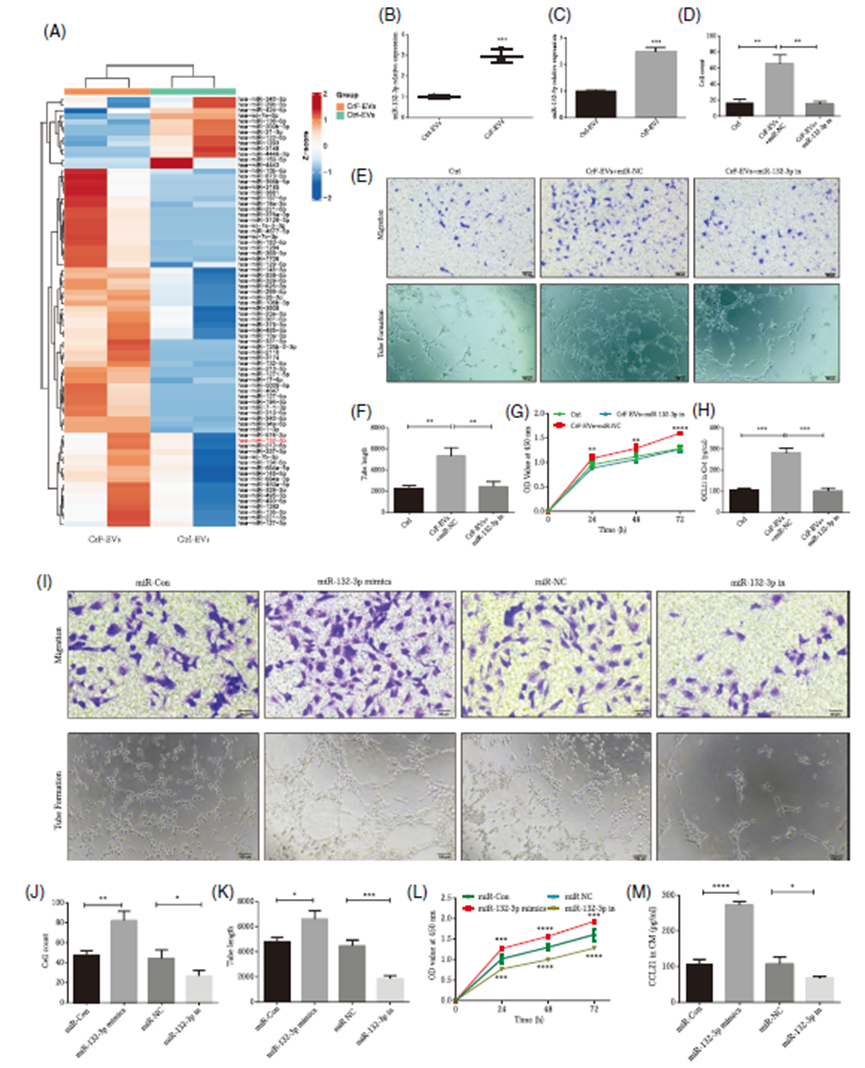
图2. CrF-EVs通过递送miR-132-3p改善淋巴管内皮细胞功能
CrF-EV-miR-132-3p对体内淋巴管生成和炎症的影响
生物信息学分析预测miR-132-3p可能通过靶向RASA1激活ERK1/2信号通路发挥作用。在Il-10-/-小鼠中,CrF-EVs可抑制肠系膜和结肠淋巴管中Rasa1的表达,促进淋巴管生成和淋巴引流;抑制miR-132-3p则可逆转这些作用,导致淋巴管密度和淋巴引流功能恢复到未治疗水平,同时炎症症状也再次加重,表明CrF-EV-miR-132-3p在体内通过调节淋巴管功能抑制炎症。
临床样本中miR-132-3p与CD的相关性
对CD患者的临床样本分析发现,疾病肠道和相应肠系膜(CrF)中miR-132-3p水平显著高于边缘组织和对照组,且与淋巴管密度呈正相关。同时,CrF中miR-132-3p与脂肪因子脂联素(ADP)和淋巴管生成因子VEGF-C呈正相关,与炎症因子TNF-α和IL-6呈负相关,提示miR-132-3p在CrF中的升高可能具有刺激淋巴管生成和抗炎作用。此外,血清miR-132-3p水平在活动期CD患者中显著高于缓解期患者和健康对照,且与CDAI呈正相关,表明血清miR-132-3p可作为监测CD疾病活动度的潜在生物标志物。

图3. miR-132-3p的高表达与CD患者的淋巴管密度(LVD)和炎症密切相关
总体而言,本研究表明,CrF-EVs通过传递miR-132-3p,靶向RASA1/ERK1/2轴,有效改善了CD小鼠模型的淋巴功能,减轻了结肠炎和肠系膜炎症。临床样本分析进一步证实了miR-132-3p在CD患者中的表达变化及其与疾病活动的紧密联系。尽管研究存在一定局限性,如CrF微环境复杂导致难以明确ADSCs及其EVs变化的具体原因,以及miR-132-3p调节淋巴管生成的下游靶点尚未完全阐明,但这些发现为深入理解CD发病机制提供了新视角,也为开发基于EVs和miRNA的治疗策略提供了理论依据。未来,可进一步探索生物工程技术在靶向递送miR-132-3p治疗CD方面的应用,有望为CD患者带来新的治疗希望。(生物谷Bioon.com)
参考文献:
Shu W, Wang Y, Chen M, et al. Extracellular vesicles derived from creeping fat stem cells promote lymphatic function and restrain inflammation of Crohn's disease. Clin Transl Med. 2024;14(12):e70086. doi:10.1002/ctm2.70086
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


