EMBO J:由外至内,搞定Aβ!中国科学家发现治疗阿尔茨海默病新机制
来源:奇点糕 2022-12-12 16:26
揭示了Aβ介导的巨噬细胞吞噬作用可能是对Aβ细胞毒性的反馈调节。而EPO不仅仅对神经元有保护作用,也大量地参与到了Aβ介导的巨噬细胞吞噬通路中,并对炎症抑制和阿尔茨海默病的病理有积极的影响。
阿尔茨海默病是最常见的失智症,因其发病率逐年升高,已经成为了全球范围内的健康难题[1]。
β-淀粉样蛋白(Aβ)被认为是散发型阿尔茨海默病的标志物之一。Aβ相关的学说认为,不断累积的Aβ造成的神经毒性是疾病的诱因之一,没有办法及时清除Aβ也是散发型阿尔茨海默病的主要原因[2]。
一些研究表明,脑内Aβ和外周血液里的Aβ存在着一种生理平衡,清除外周血液中的Aβ也有助于减少脑内的Aβ沉积[3-4]。因此,明确外周血液Aβ的清除机制对未来发现阿尔茨海默病的新型疗法非常重要。
近期,由南京医科大学张志远教授和陆军军医大学张志仁教授领衔的研究团队,在著名期刊The EMBO Journal上发表重要研究成果[5]。
他们发现,促红细胞生成素(EPO)可以提高巨噬细胞的吞噬活性和Aβ降解酶的水平,并通过PPARγ通路增强由巨噬细胞介导的外周血中Aβ的清除作用。与此同时,EPO也可抑制由Aβ引起的炎症反应,促进大脑中Aβ的外排。

论文首页截图
研究人员将腹腔巨噬细胞(Peritoneal Macrophages,PMs)分别培养在含有Aβ42或Aβ40的培养基中,并加入有荧光标记的Aβ42(Hilyte-Aβ42),由此观察体外Aβ吞噬作用。
结果发现,在Aβ42中培养的PMs,对Aβ42和Aβ40的吞噬作用都大大提高,但细胞的存活率并没有受到影响。而在Aβ40中培养的PMs则没有被观察到相同的反应,说明Aβ42可以特异性增强巨噬细胞的吞噬作用。
为了在离体细胞模型中验证在PMs中观察到的结果,研究人员给8周大的野生型小鼠(WT)分别注射Aβ42及Aβ40,并将其脾脏巨噬细胞提取纯化,用于检测其吞噬作用。
他们发现,注射Aβ42的WT小鼠(一天两次静脉注射,0.2毫摩尔/千克/天),其脾巨噬细胞也表现出了对Aβ吞噬作用的升高,而在注射Aβ40的WT小鼠,其脾巨噬细胞则未表现出对Aβ吞噬作用的升高。
相似的结果也体现在了转基因小鼠实验中。该研究使用的转基因小鼠模型(APP/PS1-21),同时表达了突变的淀粉样蛋白(APP)和早老蛋白(PS1-21)基因,与WT小鼠不同,其本身就存在较高的脾脏Aβ42水平[6]。
研究人员发现,在6周大的APP/PS1-21小鼠脾脏中,随着Aβ42水平升高,脾巨噬细胞的Aβ42吞噬活性也相应升高。也进一步说明了Aβ42的刺激能够促进外周巨噬细胞对Aβ42和Aβ40的吞噬作用。
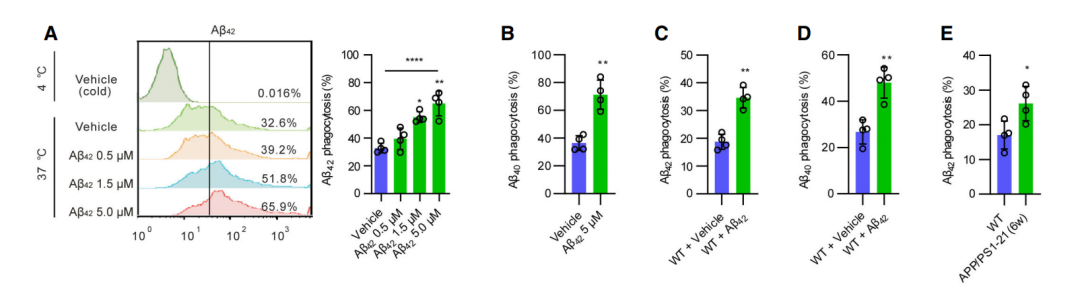
经过Aβ42培养后,PMs(A-B)以及从小鼠体内中提出的脾巨噬细胞(C-E)对Aβ吞噬作用的变化
有趣的是,Aβ42可以诱导产生小胶质细胞诱导缺氧因子-1a(HIF-1a),后者是EPO重要的转录因子[7]。并且在之前的研究中,EPO被发现可以提高巨噬细胞对凋亡细胞的吞噬作用,因此研究人员决定进一步探究Aβ42对EPO信号通路的作用。
在PMs以及WT小鼠和APP/PS1-21小鼠的脾脏巨噬细胞中,Aβ42都被发现能够提高EPO,EPO受体(EPOR)以及EPOR巨噬作用激活因子p-JAK2的蛋白表达。而在敲除了EPOR的小鼠巨噬细胞中,Aβ42对以上蛋白表达并无显著影响。这些实验表明,Aβ42可以通过EPOR介导巨噬细胞EPO信号通路。
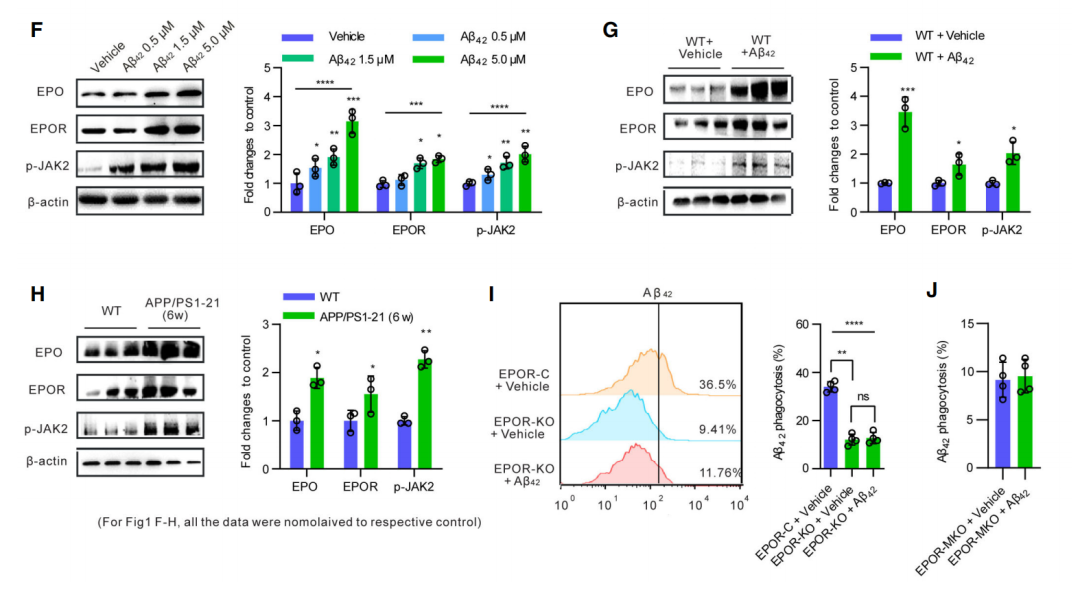
在体外以及离体培养的巨噬细胞中,Aβ42都能提高其EPO,EPOR以及p-JAK2的表达
在确定Aβ42能够影响EPO信号通路之后,研究人员进一步发现EPO能够增强巨噬细胞清除Aβ的作用,并且能够抑制Aβ引起的炎症反应。
研究人员将PMs培养在含有重组人源EPO(rhEPO)的培养基中,发现其对Aβ42和Aβ40的吞噬活性都大有提升。而EPOR缺失的巨噬细胞对Aβ42的吞噬活性降低了65%,这种活性的降低是外源性的rhEPO无法弥补的。
该研究也发现,rhEPO可以降低包括TNF-a,IL-1β在内的多项炎症调节因子水平,同时也可以升高包括Arg-1和IL-10在内多项抗炎因子的水平。这些结果也表明,巨噬细胞EPO信号通路在提高Aβ清除相关的吞噬活性,蛋白降解和炎症反应中有重要的作用。
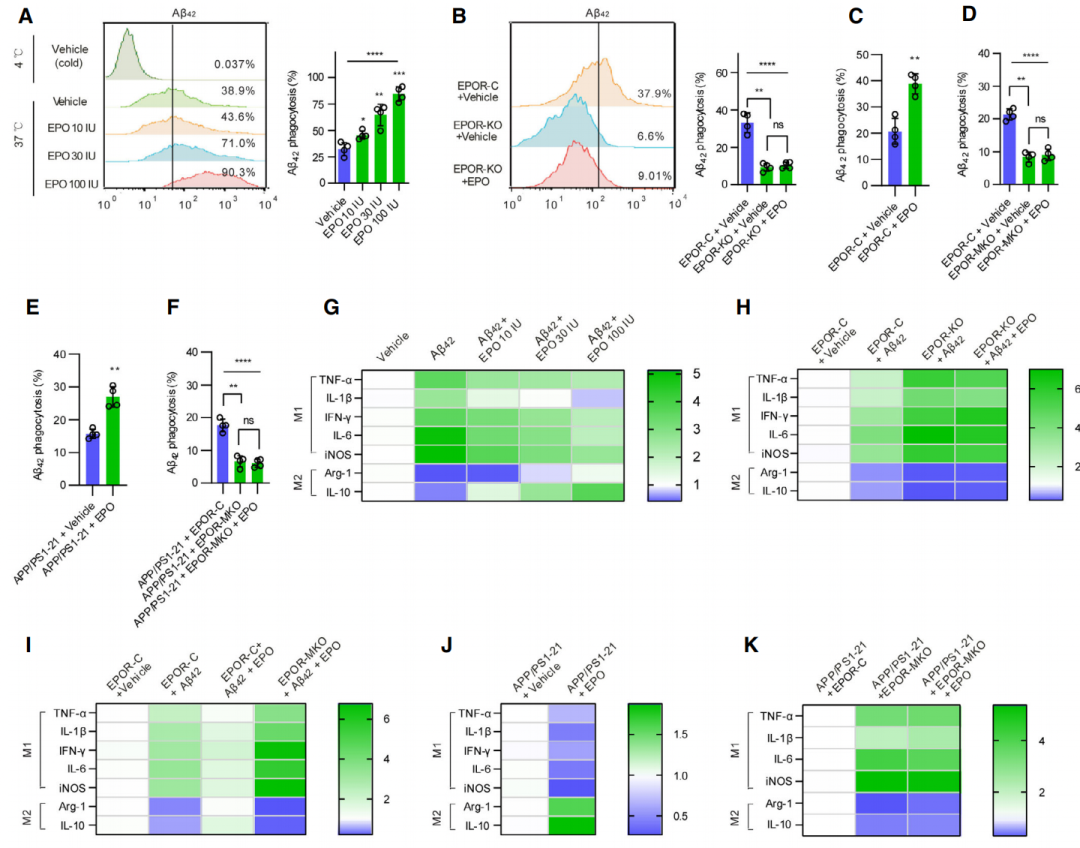
加入rhEPO后对体外巨噬细胞及各小鼠模型的离体脾脏巨噬细胞吞噬作用的影响(A-F),以及炎症因子(M1)和抗炎因子(M2)的表达变化(G-K)
那么EPO和EPOR是通过什么机制来影响巨噬细胞清除Aβ呢?
鉴于PPARγ可以提高骨髓细胞中可溶性Aβ的清除作用,研究人员也对其在巨噬细胞中的作用进行了探索[8]。
他们发现在PMs中,Aβ42和rhEPO可以提高PPARγ和SRA(Scavenger receptor A,一种介导PPARg基因表达的受体)的蛋白浓度,而在缺失EPOR的PMs中,这两种蛋白的浓度会降低。
相同的结果也在敲除EPOR(EPOR-MKO)的小鼠模型中被证实,相较于WT小鼠,EPOR-MKO小鼠PPARγ和SRA水平分别下降了80%和60%。因此可以推断,Aβ42可以通过介导巨噬细胞EPO通路来影响PPARγ的表达,进而达到清除Aβ的效果。
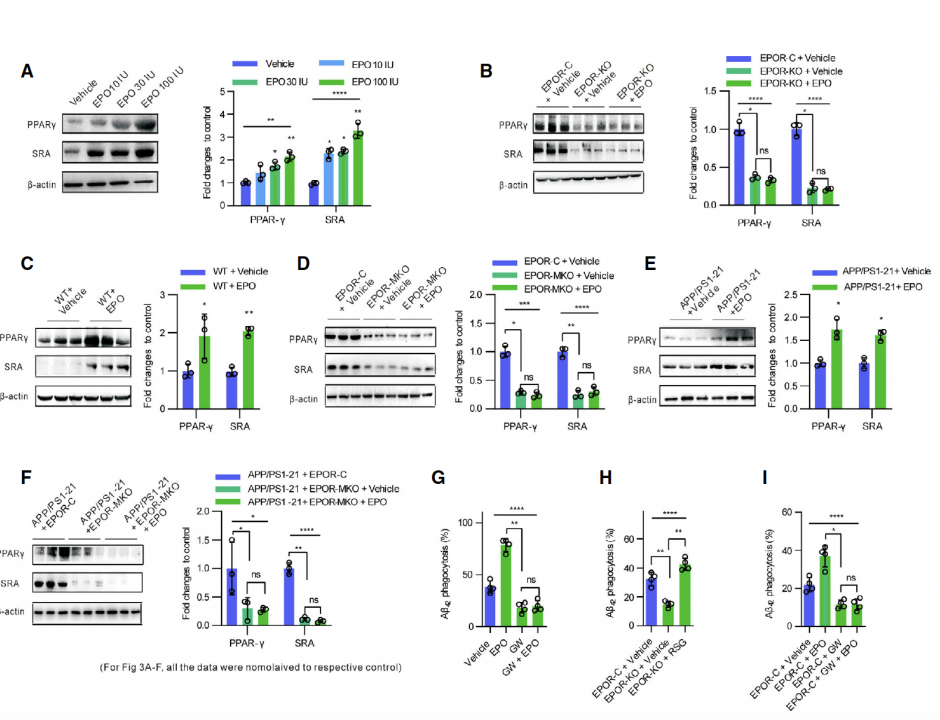
Aβ42和rhEPO对PPARγ和SRA表达水平的影响
除此之外EPO信号通路不仅能在外周巨噬细胞中调节外周Aβ的累积,还可以调节大脑Aβ的外排和大脑中的Aβ沉积[9]。小鼠在经过EPO治疗后,脾脏内Aβ42水平升高了两倍,而海马体内Aβ42的水平和沉积则大大降低。这也表明EPO可以促进大脑Aβ的外排以及减少Aβ沉积。
与此同时,在APP/PS1-21小鼠模型中,缺失了EPOR的外周巨噬细胞也被发现加速了大脑阿尔茨海默病的病理和症状。
该研究通过大量的细胞实验和小鼠实验,揭示了Aβ介导的巨噬细胞吞噬作用可能是对Aβ细胞毒性的反馈调节。而EPO不仅仅对神经元有保护作用,也大量地参与到了Aβ介导的巨噬细胞吞噬通路中,并对炎症抑制和阿尔茨海默病的病理有积极的影响。
由于血脑屏障的存在和大脑独特的免疫系统,对脑部疾病的治疗和病理蛋白的靶向清除一直是研究领域中的难题。而这项研究的发现,则为阿尔茨海默病的治疗提供了新的思路。如果能通过更容易给药和治疗的外周系统,减轻大脑中的病理负担,对于遇到了瓶颈的阿尔茨海默病研究,可谓是再好不过的消息了。
参考文献:
[1] Lane CA, Hardy J, Schott JM. Alzheimer's disease. Eur J Neurol. 2018;25(1):59-70. doi:10.1111/ene.13439
[2] Selkoe DJ, Hardy J. The amyloid hypothesis of Alzheimer's disease at 25 years. EMBO Mol Med. 2016;8(6):595-608. Published 2016 Jun 1. doi:10.15252/emmm.201606210
[3] Wang C, Chen T, Li G, Zhou L, Sha S, Chen L. Simvastatin prevents β-amyloid(25-35)-impaired neurogenesis in hippocampal dentate gyrus through α7nAChR-dependent cascading PI3K-Akt and increasing BDNF via reduction of farnesyl pyrophosphate. Neuropharmacology. 2015;97:122-132. doi:10.1016/j.neuropharm.2015.05.020
[4] Wang J, Gu BJ, Masters CL, Wang YJ. A systemic view of Alzheimer disease - insights from amyloid-β metabolism beyond the brain [published correction appears in Nat Rev Neurol. 2017 Oct 13;:]. Nat Rev Neurol. 2017;13(10):612-623. doi:10.1038/nrneurol.2017.111
[5] Xu L, Li L, Pan CL, et al. Erythropoietin signaling in peripheral macrophages is required for systemic β-amyloid clearance. EMBO J. 2022;41(22):e111038. doi:10.15252/embj.2022111038
[6] Gengler S, Hamilton A, Hölscher C. Synaptic plasticity in the hippocampus of a APP/PS1 mouse model of Alzheimer's disease is impaired in old but not young mice. PLoS One. 2010;5(3):e9764. Published 2010 Mar 22. doi:10.1371/journal.pone.0009764
[7] Heckmann BL, Teubner BJW, Tummers B, et al. LC3-Associated Endocytosis Facilitates β-Amyloid Clearance and Mitigates Neurodegeneration in Murine Alzheimer's Disease [published correction appears in Cell. 2020 Dec 10;183(6):1733-1734]. Cell. 2019;178(3):536-551.e14. doi:10.1016/j.cell.2019.05.056
[8] Cramer PE, Cirrito JR, Wesson DW, et al. ApoE-directed therapeutics rapidly clear β-amyloid and reverse deficits in AD mouse models. Science. 2012;335(6075):1503-1506. doi:10.1126/science.1217697
[9] Cheng Y, Tian DY, Wang YJ. Peripheral clearance of brain-derived Aβ in Alzheimer's disease: pathophysiology and therapeutic perspectives. Transl Neurodegener. 2020;9(1):16. Published 2020 May 7. doi:10.1186/s40035-020-00195-1
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


