实体瘤治疗新方法!Sci Transl Med:改良的 C 型利钠肽能够使肿瘤脉管系统正常化,恢复抗肿瘤免疫力
来源:网络 2024-08-27 09:08
本研究报道了一种改良的CNP衍生物(dCNP),具有优异的药代动力学和药效学特性,能有效改善肿瘤血管功能、减少缺氧、抑制基质生成、增强免疫反应,并提升化疗、放疗和免疫治疗的效果,显示出积极的开发前景。
在实体肿瘤中,功能失调的血管和恶性肿瘤微环境(TME)导致药物输送不畅和免疫抑制,从而降低了治疗效果。虽然血管扩张剂和抗纤维化药物可以改善肿瘤灌注,但实际应用中仍面临挑战。另一种方法是使用功能性血管生成激活剂,如C型利钠肽(CNP),该物质具有促进血管生成和抗纤维化的作用。然而,由于CNP的体内半衰期短,这在一定程度上限制了它的应用。
近日,美国宾夕法尼亚大学的Serge Y. Fuchs研究团队在Sci Transl Med上发表了题为Modified C-type natriuretic peptide normalizes tumor vasculature, reinvigorates antitumor immunity, and improves solid tumor therapies的研究论文,报道了一种改良的CNP衍生物(dCNP)。这种衍生物作用于人和小鼠的内皮细胞(EC),相较于天然CNP表现出更优异的药代动力学和药效学特性。dCNP能够有效改善肿瘤血管功能、减少缺氧、抑制基质生成、增强免疫反应,同时提升化疗、放疗和免疫治疗的效果,显示出积极的开发前景。
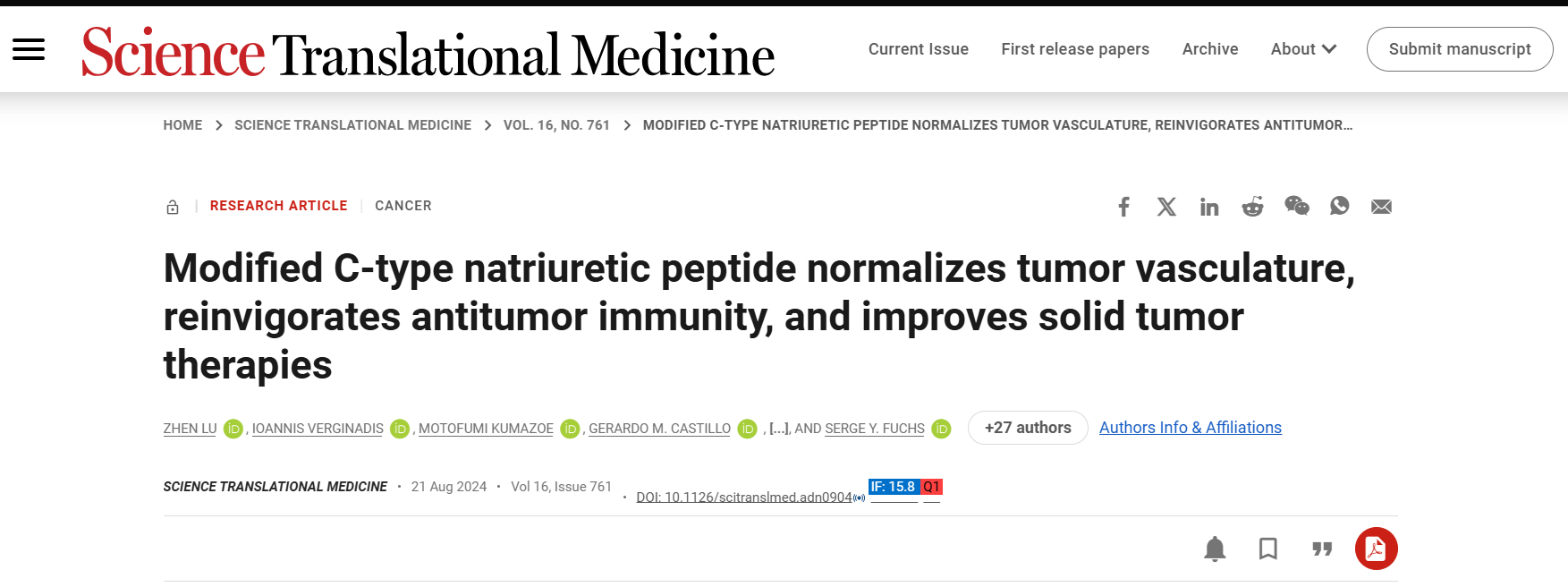
为克服CNP半衰期短的问题,研究人员通过将CNP的N端与C18-酰化延伸氨基酸尾部偶联,生成了dCNP。与天然CNP相比,dCNP在小鼠中表现出更优越的药代动力学和药效学特性。dCNP在多种动物实验中均显示出良好的耐受性,并未引起明显副作用。
研究表明,dCNP通过多重机制发挥作用,包括增加cGMP水平、保护内皮细胞、抑制肿瘤坏死因子-α(TNFα)引起的血管生成素1(ANGPT1)下调以及抑制VE-钙黏蛋白丧失。在小鼠肿瘤模型中,dCNP促进了VE-钙黏蛋白、ICAM-1、VCAM-1等关键分子的表达,并调控了与缺氧、TGFβ通路、成纤维细胞活化、基质生成和免疫反应相关的基因表达。
dCNP通过一系列机制改善了肿瘤微环境(TME),包括正常化肿瘤血管、抑制基质生成、重新激活抗肿瘤免疫反应。在几种小鼠肿瘤模型中,dCNP显著减少了肿瘤内的缺氧情况,并促进了血管的形成和延展。此外,dCNP降低了肿瘤血管的扭曲程度,减少了血管渗透性,增加了血管周细胞覆盖,从而改善了肿瘤组织的灌注。同时,dCNP还减少了肿瘤基质中的透明质酸和胶原蛋白I等成分,降低了纤维母细胞活化蛋白(FAP)的表达,进一步缓解了肿瘤间质生成和肿瘤内压力。这些作用有助于缓解肿瘤内的高压和缺氧状态,促进功能性血管的形成和肿瘤组织的灌注。

图 1. dCNP 使肿瘤脉管系统正常化,减轻缺氧,并抑制基质生成
在免疫反应方面,dCNP通过增加肿瘤浸润的细胞毒性T淋巴细胞(CTLs)、自然杀伤细胞(NK细胞)和I型树突状细胞的数量,同时减少了多形核髓源性抑制细胞(PMN-MDSCs)和调节性T细胞(Tregs)的数量,从而打破了肿瘤微环境中的免疫特权地位。此外,dCNP还促进了CTLs的效应功能,增加了IFN-γ、颗粒酶B和穿孔素等标记物的表达,同时减少了耗竭标记物(如PD-1和TIM-3)的表达。
dCNP单药在MC38结肠腺癌、MH6419c5胰腺癌和免疫炎症MH6499c4肿瘤模型中展现了显著的抗肿瘤效果。中等剂量的dCNP(0.3 mg/kg)有效减缓肿瘤生长并延长小鼠生存期,而增加剂量至0.6 mg/kg并未降低疗效,这与抗VEGF药物的高剂量副作用形成对比。在缺乏淋巴细胞的MC38OVA肿瘤模型中dCNP无效,强调了适应性免疫系统在其作用机制中的重要性。此外,dCNP还抑制了多种肿瘤的生长,包括K7M2骨肉瘤、Hepa1-6肝细胞癌和TRAMP-C1前列腺腺癌,且去除CTLs会减弱dCNP的抗肿瘤效果。
在评估dCNP对B16F10黑色素瘤肺转移的影响时,研究发现尽管其对原发肿瘤生长影响不大,但能显著减少肺部转移病灶并提高生存率,表明其在转移疾病管理中的潜力。针对肿瘤灌注不足可能影响治疗效果的问题,dCNP可与化疗、放疗和免疫治疗等多种抗癌手段联合应用。与顺铂联合使用时,dCNP提高了其在原位E0771乳腺肿瘤中的浓度,改善了抗肿瘤效果。与FOLFOX方案联用时,dCNP提升了抗肿瘤效应并延长了生存期,同时增加了肿瘤内CTL的频率,减少了Tregs和PMN-MDSCs的数量。此外,dCNP还增强了CTL的增殖和效应功能,并降低了疲劳标志物。
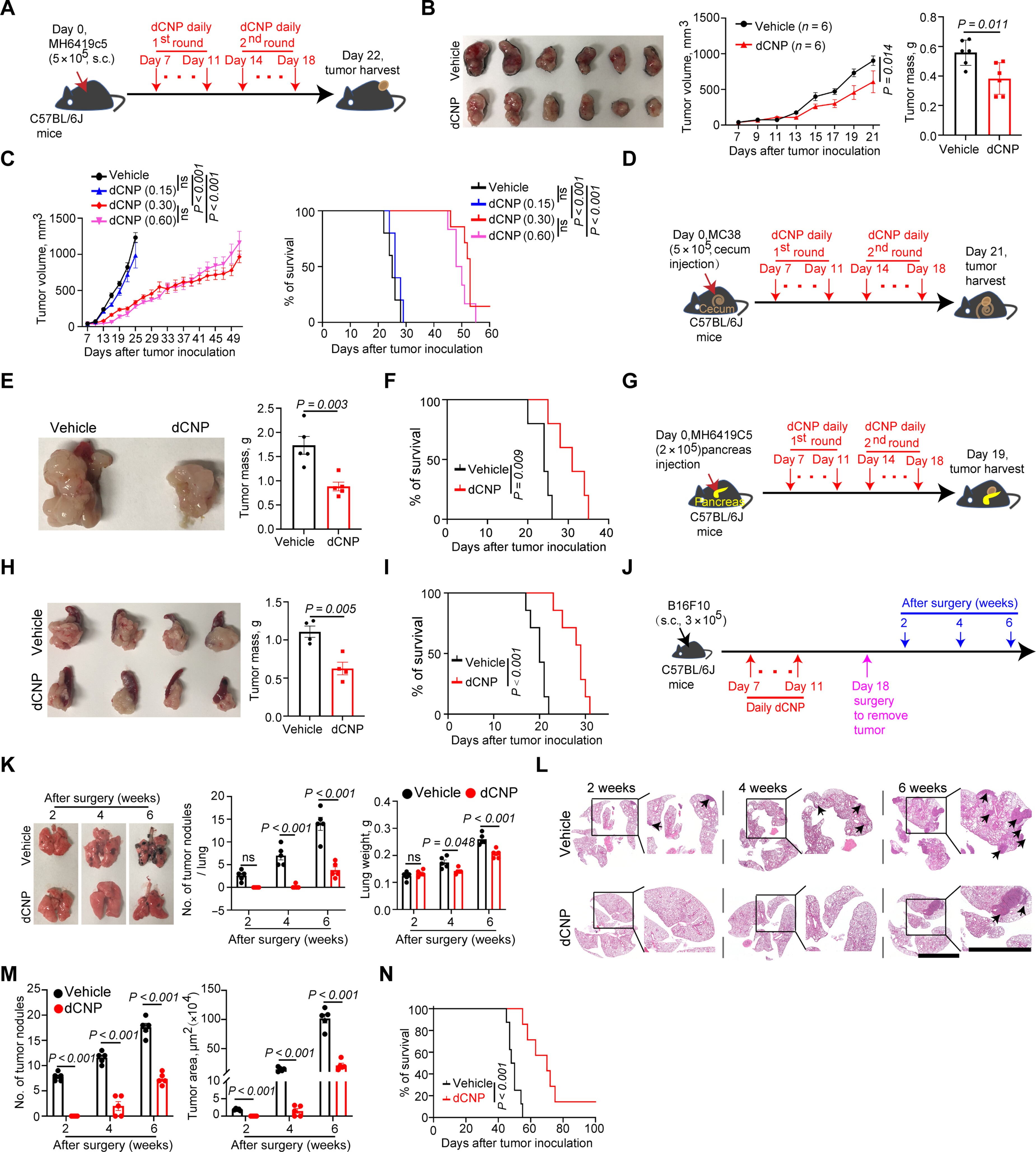
图 2. dCNP 治疗可抑制肿瘤生长和转移
此外,dCNP还被证明能够改善放疗的效果,特别是在缓解肿瘤内缺氧方面。与抗PD-1治疗联合时,dCNP显著减少了肿瘤体积并延长了生存期,改善了CTL的增殖和活性,降低了疲劳标志物。这种联合治疗在MH6419c5胰腺癌、RENCA肾皮质腺癌和E0771乳腺癌等多种肿瘤模型中均显示了良好效果。最后,dCNP与CAR-T细胞疗法联用时,显著提高了CAR-T细胞的肿瘤浸润和抗肿瘤效能,并延长了小鼠生存期。这些结果表明,dCNP可以增强免疫检查点抑制和CAR-T免疫疗法在固体肿瘤中的治疗效果。
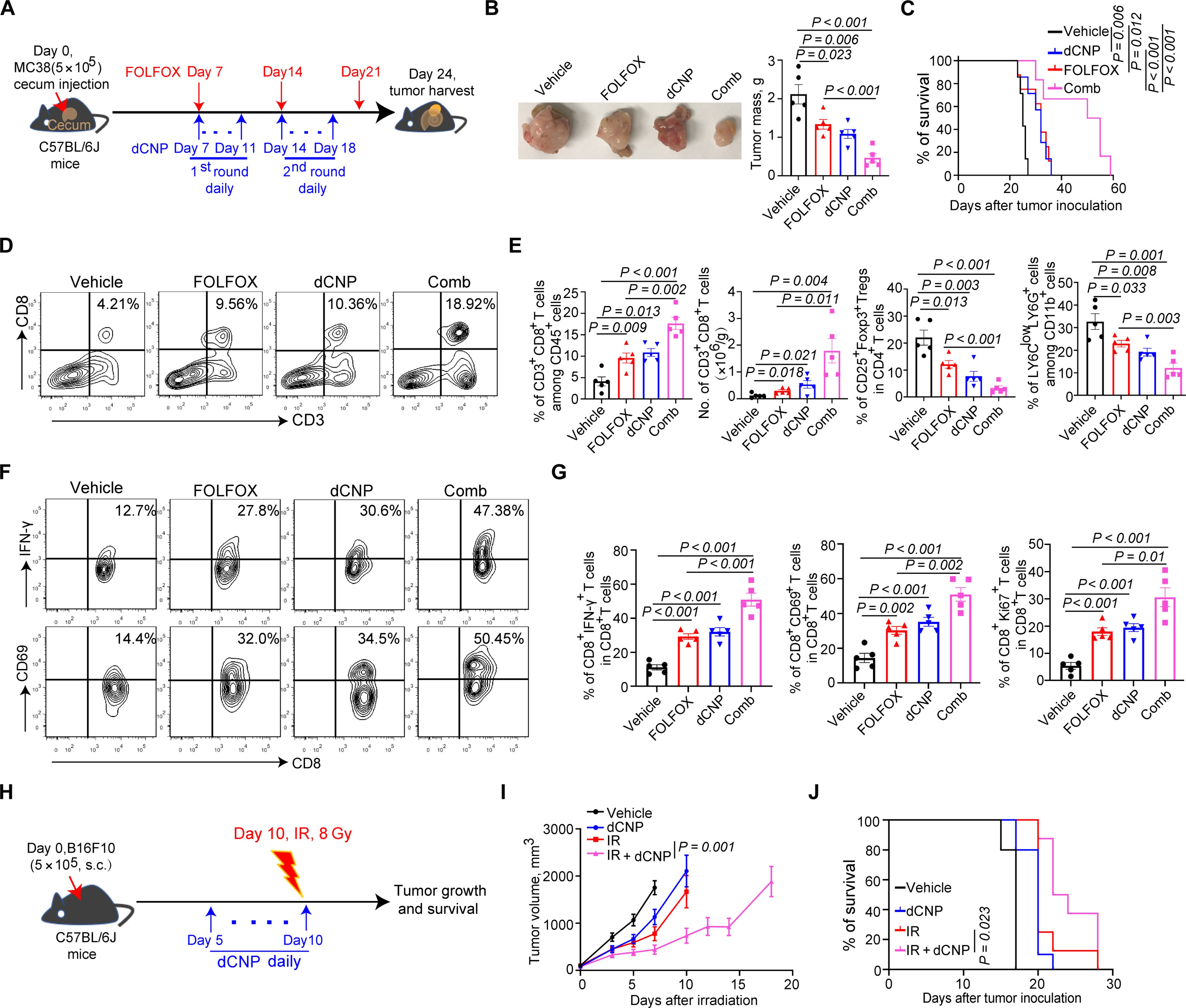
图 3. dCNP 可改善化疗/放疗效果
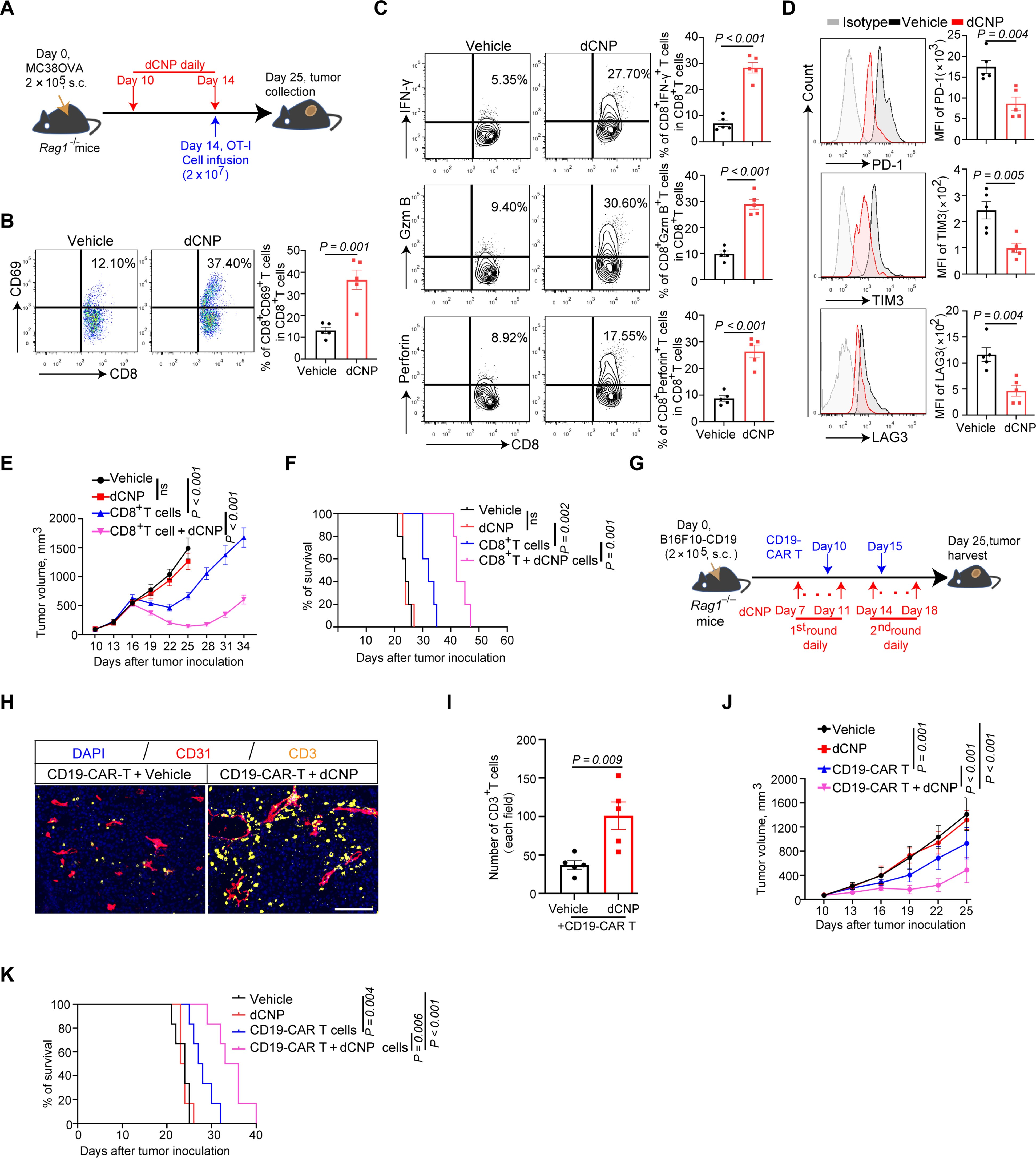
图 4. dCNP 提高了CAR T疗法的疗效
总体而言,本研究发现改良型CNP(dCNP)具有优于天然CNP的药代动力学和药效学特性,能够正常化肿瘤微环境(TME)、改善肿瘤组织灌注、减少缺氧和肿瘤间质间隙压力(TIFP),并增强抗肿瘤免疫反应。它对胰腺导管腺癌、结肠腺癌、肺腺癌等多种实质性肿瘤展现了显著的抗肿瘤效果。此外,dCNP还能与化疗、放疗和免疫治疗联合使用,以提高治疗效果。研究表明,dCNP主要在肿瘤的缺氧区域内发挥作用,它通过改善血管灌注和减少免疫抑制,重新激发抗肿瘤免疫反应,而对健康组织无明显影响。以上结果表明,dCNP在TME规范化治疗方面具有积极的开发前景。(生物谷Bioon.com)
参考文献:
Lu Z, Verginadis I, Kumazoe M, et al. Modified C-type natriuretic peptide normalizes tumor vasculature, reinvigorates antitumor immunity, and improves solid tumor therapies. Sci Transl Med. 2024;16(761):eadn0904. doi:10.1126/scitranslmed.adn0904
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


