Redox Biology: 首都医科大学研究者们对低温和常温神经保护的精确探索提供了理论基础
来源:生物谷原创 2024-05-30 10:40
该研究揭示了吩噻嗪通过RIPK1/RIPK3-DRP1或HIF-1α信号通路调节NLRP3炎症组相关炎症反应在急性缺血性卒中低温和常温神经保护中的作用。
急性缺血性中风(AIS)是世界范围内最常见的疾病之一,具有很高的死亡率和致残率。它占所有类型中风的85%。炎症反应和细胞死亡是卒中病理的标志。目前,血管重建术是缺血性中风的主要治疗方法,然而,接受这种治疗的患者往往需要补充神经保护策略。
氯丙嗪和异丙嗪(C+P)是两种吩噻嗪类抗神经药。他们认为,中风的神经保护被认为是由于诱导了一种以冬眠为基础的状态,然而,一些研究表明,C+P的神经保护作用只是通过低温部分实现的。因此,C+P低温和常温效应的神经保护机制尚不清楚。
受体相互作用蛋白(RIPK)是一个丝氨酸-苏氨酸激酶家族,由7个亚型RIPK1-7组成,已被证明在卒中后脑部炎症和细胞死亡的背景下具有活性。RIPK1通过C端RIP同型相互作用基序(RHIM)结构域与RIPK3结合,形成RIPK1/RIPK3复合体,启动下游信号转导,触发坏死死亡。除坏死性死亡外,RIPK1/RIPK3活性与炎症反应密切相关。
核苷酸结合寡聚化结构域(NOD)样受体(NLR)家族吡咯结构域包含3(NLRP3)炎症小体的激活需要RIPK1的激酶活性,而RIPK1与炎症细胞因子的产生有关。RIPK1导致线粒体功能障碍,导致小鼠纤维肉瘤L929细胞死亡,而RIPK1抑制剂(Nec1s)阻止线粒体释放细胞色素c,阻止细胞凋亡。此外,RIPK1抑制剂减少了caspase-9介导的大鼠横纹肌溶解后的细胞凋亡。

图片来源:https://doi.org/10.1016/j.redox.2024.103169
近日,来自首都医科大学的研究者们在Redox Biology杂志上发表了题为“Modulation of NLRP3 inflammasome-related-inflammation via RIPK1/RIPK3-DRP1 or HIF-1α signaling by phenothiazine in hypothermic and normothermic neuroprotection after acute ischemic stroke”的文章,该研究揭示了吩噻嗪通过RIPK1/RIPK3-DRP1或HIF-1α信号通路调节NLRP3炎症组相关炎症反应在急性缺血性卒中低温和常温神经保护中的作用。
炎症和随后的线粒体功能障碍和细胞死亡会恶化缺血性卒中血管重建后的预后。受体相互作用蛋白激酶1激活含3(NLRP3)炎症体依赖的NLRP3结构域中的动力素相关蛋白1,低氧诱导因子1α在此过程中起关键作用。这项研究确定了低温和常温模式下的吩噻嗪类药物(氯丙嗪和异丙嗪,C+P)如何影响RIPK1/RIPK3-DRP1和HIF-1α通路,从而提供神经保护。
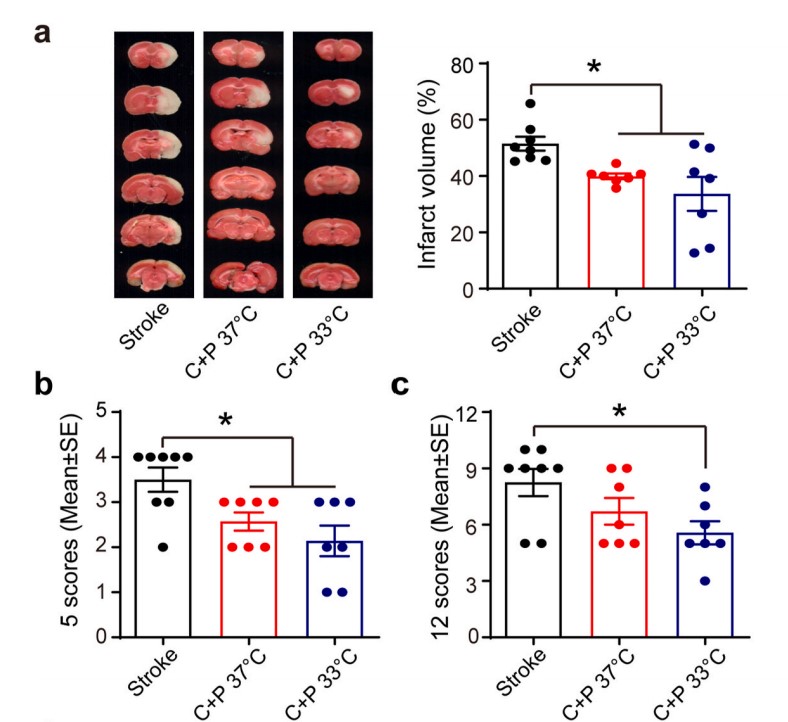
C+P减轻脑缺血再灌流后的脑损伤和细胞凋亡
图片来源:https://doi.org/10.1016/j.redox.2024.103169
成年雄性SD大鼠150只,大脑中动脉闭塞(MCAO)2 h,再灌注24 h。再灌流开始时给予C+P 8 mg/kg。观察心肌梗死体积、缺氧诱导因子-1α、RIPK-1、RIPK-3、DRP-1、NLRP3-炎症反应和细胞色素c-凋亡的表达。
检测细胞凋亡率、中性粒细胞和巨噬细胞的浸润以及线粒体功能。检测RIPK1/RIPK3与HIF-1α/NLRP3的相互作用。在缺氧缺糖(OGD)的SH-SY5Y细胞中,观察常温下C+P对炎症和细胞凋亡的影响。
C+P可显著减少心肌梗死体积、线粒体功能障碍(ATP和ROS浓度、柠檬酸合成酶和ATPase活性)、炎症反应和细胞凋亡。33◦C的C+P和RIPK1抑制剂(Nec1s)均能显著降低RIPK1、RIPK3、DRP1、NLRP3-炎症体和细胞色素c的过度表达,提示C+P的降温作用是通过RIPK1/RIPK3-DRP1途径实现的。当体温维持在37◦C时,CP和低氧诱导因子1α抑制剂可降低低氧诱导因子-1α的表达,从而减少线粒体功能障碍、NLRP3炎症体和细胞色素c-凋亡,以及HIF-1α和NLRP3的相互作用。这些在体外也得到了证实,表明C+P通过HIF-1α发挥常温作用。

氯丙嗪和异丙嗪在缺血性卒中中的神经保护作用
图片来源:https://doi.org/10.1016/j.redox.2024.103169
总之,在缺血性卒中的结局中,C+P治疗的双重模式成为一种引人注目的神经保护策略。
这项研究中提出的证据,以及之前的研究,有力地确立了C+P通过明显受热状态影响的机制减轻神经元损伤的有效性。在低温神经保护的核心,C+P靶向RIPK1/RIPK3-Drp1途径,减轻线粒体功能障碍和随后加剧脑损伤的炎症级联反应。
相反,在常温条件下,C+P通过调节HIF-1α途径发挥其保护作用,提供一种屏障,抵御因中风病理固有的缺氧挑战而持久存在的炎症和细胞凋亡。此外,本研究结果强调了温度调节在卒中治疗中的微妙作用,并建议可以通过考虑热环境来优化C+P的治疗应用。由于低温介导的途径提供了一种保护途径,而常温提供了替代机制,C+P的多功能性是显而易见的,提供了更广泛的治疗窗口和对患者特定情况的适应。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


