历史性时刻:FDA批准首款CRISPR基因编辑疗法!见证120年来人类生物医学的进步
来源:生物世界 2023-12-11 15:22
美国食品和药物监督管理局(FDA)做出了一项真正具有历史意义的决定——批准了Casgevy上市,这是一款基于CRISPR技术的开创性基因编辑疗法,用于治疗12岁及以上伴有复发性
美国食品和药物监督管理局(FDA)做出了一项真正具有历史意义的决定——批准了Casgevy上市,这是一款基于CRISPR技术的开创性基因编辑疗法,用于治疗12岁及以上伴有复发性血管闭塞危象的镰状细胞病(SCD)患者。
值得一提的是,CRISPR基因编辑,是一项只有10年历史的新技术,而此次获批的疗法却是用在了治疗近75年前被莱纳斯·鲍林(Linus Pauling)称为“第一种分子疾病”的遗传疾病——镰状细胞病(SCD)。
此次FDA的批准,是在英国药品和健康产品管理局(MHRA)批准Casgevy两周后作出的。

该疗法是由诺贝尔化学奖得主、CRISPR 基因编辑先驱 Emmanulle Charpentier 创立的 CRISPR Therapeutics 公司于2018年启动,此后与 Vertex Pharmaceuticals 合作推进。
镰状细胞病
每两分钟,就有一名患有镰状细胞病(SCD)的婴儿出生,这是一种常染色体隐性遗传疾病,是由表达β-珠蛋白的HBB基因的 A·T-to-T·A 点突变引起,突变导致β-珠蛋白上第六位原本的谷氨酸被替换成缬氨酸,进而导致红细胞形态异常,呈现镰刀型,因此也叫做镰刀状细胞贫血症。据推测,这一突变最初出现在大约7000年前的撒哈拉以南的非洲地区。
镰状细胞病(SCD)患者会出现包括贫血、严重急性/慢性疼痛、免疫缺陷、多器官衰竭,甚至过早死亡。异基因造血干细胞移植(骨髓移植)是目前唯一被FDA批准的治疗这种遗传疾病的方法,然而,骨髓移植费用巨大、配型极其困难,因此,绝大多数患者只能依赖频繁输血维持生命,不仅给家庭带来极大经济负担,患者的生活质量也很低。
120年来,对镰状细胞病(SCD)的研究标志着生物医学进步的最前沿。
1910年,芝加哥的一名内科医生James Herrick发表了一篇病例报告,描述了他在1904年治疗一名年轻黑人小伙时发现他有着不同寻常的“奇特的细长镰刀状”红细胞的存在。直到1922年,约翰霍普金斯大学的住院医师Verne Mason才创造了“镰状细胞贫血”这个术语。

James Herrick医生
1989年,《美国医学会杂志》(JAMA)发表了一篇文章,确认了当年这个首次被报道镰状细胞病患者名为Walter Clement Noel,他于1884年出生于加勒比海岛国格林纳达的一个富裕黑人家庭,1904年,他在完成本科学历后来到芝加哥的一个牙科学校学习,在当年11月,他因呼吸系统疾病(镰状细胞病的常见并发症)前往医院治疗,医院的实习生Ernest Irons发现了在血液检查时发现了他奇怪的红细胞,并于主治医生James Herrick讨论了这一情况。
1907年,Walter Clement Noel回到了家乡并开设了自己的牙科诊所,1916年,年仅32岁的他去世。他可能并不知道自己是历史上首个被医学文献记录的“镰状细胞病”患者。
1948年,儿科医生Janet Watson观察到,当患者的胎儿血红蛋白关闭时,镰状细胞的出现增加,这一发现为此次获批的Casgevy疗法所使用的上调血红蛋白的策略奠定了基础。
1949年,莱纳斯·鲍林(Linus Pauling)证明了镰状细胞病(SCD)是一种隐性遗传病,是由血红蛋白的改变引起,这也是人类确定的第一个分子病。

莱纳斯·鲍林
1956年,卡文迪许实验室的Vernon Ingram博士进一步发现了β-珠蛋白中的一个氨基酸替代导致了镰状细胞病(SCD)。大约同一时期,Anthony Allison博士在东非进行的流行病学研究证明,镰状细胞病(SCD)的发病率与疟疾的发生率一致,这解释了为什么非洲镰状细胞病一直如此盛行。
1970年代,简悦威和Andree Dozy首次进行了镰状细胞病(SCD)的产前DNA诊断。
2008年,哈佛医学院的 Vijay Sankaran 博士在 Science 期刊发表论文,通过全基因组关联研究,确定了BCL11A是胎儿血红蛋白(HbF)水平的关键调节器。该论文指出,作为参与γ-珠蛋白表达沉默的阶段特异性组分,BCL11A是镰状细胞病和地中海贫血中HbF再激活的新的治疗靶点。
尽管取得了一系列科学里程碑,但镰状细胞病(SCD)患者的治疗却没有得到实质性改善。直到2012年CRISPR-Cas9基因编辑技术的出现。
治疗原理及临床试验结果
BCL11A是一种转录因子,可抑制红系细胞中的γ-珠蛋白和胎儿血红蛋白表达。因此,靶向抑制BCL11A在理论上可以重新激活γ-珠蛋白表达,从而治疗地中海贫血症和镰状细胞病。
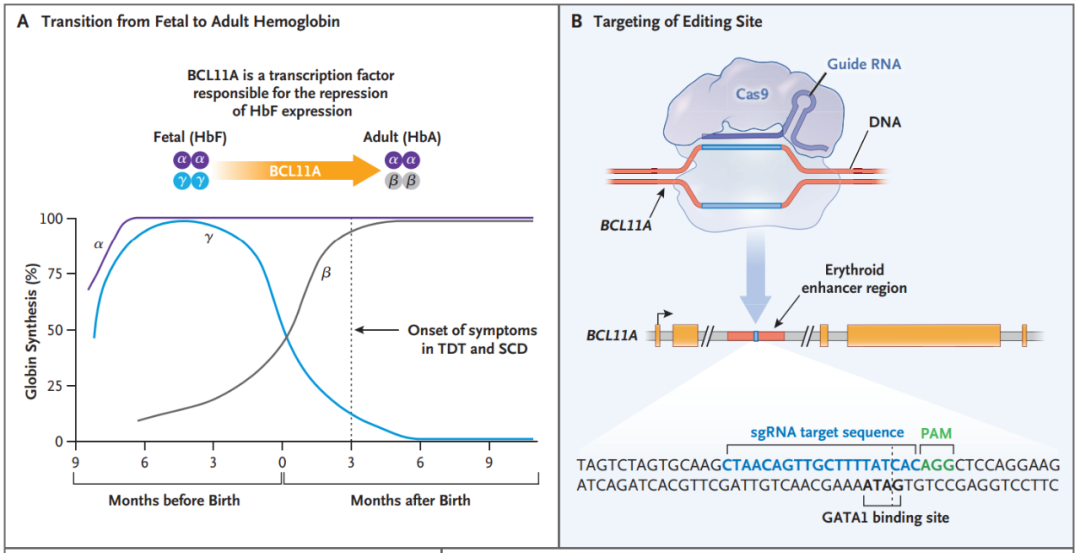
2019年7月,镰状细胞病(SCD)患者 Victoria Gray 成为第一个接受 Casgevy 疗法的人,研究团队从患者提取了 CD34+ 造血干细胞和祖细胞,然后通过电穿孔导入特异性靶向 BCL11A 增强子的 CRISPR-Cas9 基因编辑系统。
检测结果表明该位点的等位基因约有80%被编辑,循环血液中表达胎儿血红蛋白HbF的细胞占比达到99%,且没有脱靶编辑的迹象。该临床数据于2020年12月5日在《新英格兰医学杂志》(NEJM)发布。

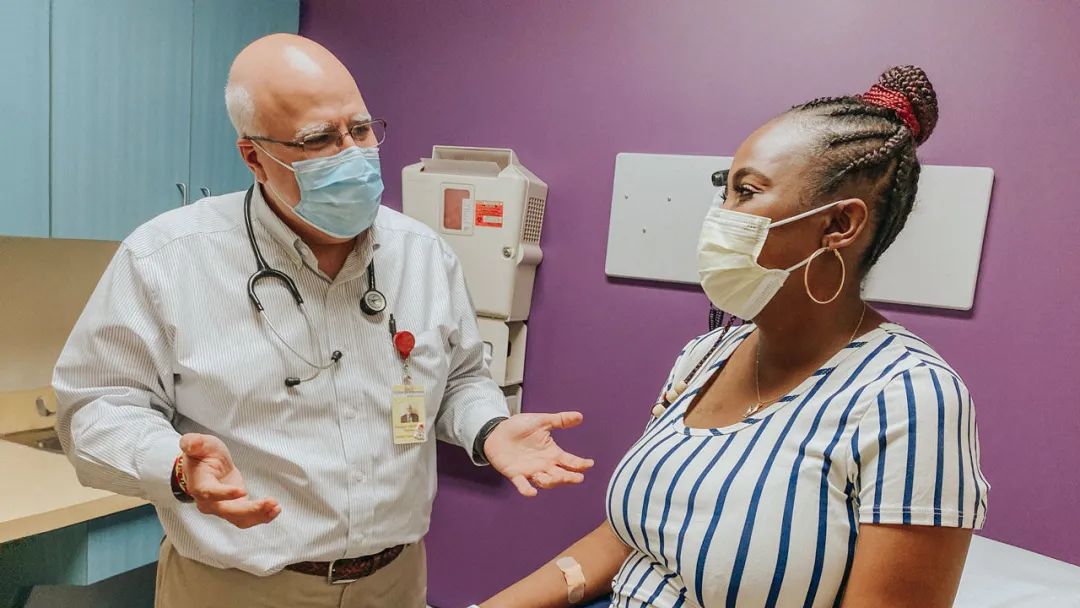
Victoria Gray(右),世界上第一位接受CRISPR基因治疗的镰状细胞病患者
如今,Victoria Gray 非常健康,不再有疼痛发作,也不需要再输血和住院。
在这项临床试验结果发布后,”基因组编辑”一词的创造者Fyodor Urnov博士盛赞了这一突破,他还建议将Victoria Gray的名字加入“生物医学史上的万神殿”,这一名单包括James Phipps(第一个接种牛痘疫苗的人)、Albert Alexander(第一个使用青霉素的人)、Louise Brown(第一个试管婴儿)和Emily Whitehead(第一个接受CAR-T细胞治疗的人)。
目前,已有45名镰状细胞病患者接受了Casgevy疗法的治疗,其中有29人的治疗时间足以得到中期结果,这29人中有28人在治疗后至少一年内缓解了疼痛发作。还有54名严重地中海贫血患者接受了Casgevy疗法的治疗,其中有42人的治疗时间足以得到中期结果,这42人中有39人在治疗后至少一年内不再需要输血,其余3人对输血的需求减少了70%以上。
几周前,FDA咨询委员会会议召集了一个专家小组,讨论的不是Casgevy疗法的临床效果,而是脱靶编辑的问题,脱靶编辑是CRISPR-Cas9技术面临的一个重要障碍。但从该疗法似乎满足了专家组对脱靶编辑问题的大部分担忧。
前路依然漫长
一方面,基于CRISPR基因编辑技术的基因疗法去的了惊人的进展,此次获得FDA批准是一个真正意义上的里程碑时刻。但如何开发出常规、可扩展、安全、价格合理且负担得起的基因编辑疗法,成为下一个关键挑战。
据悉,该疗法的定价高达220万美元。如此高昂的售价,如何让世界各地,尤其是非洲地区数以百万计的镰状细胞病(SCD)患者获益,是个值得思考的问题。
诺奖得主、CRISPR基因编辑先驱 Jennifer Doudna 教授曾表示,一次性体内注射、无需体外操作和骨髓移植的基因编辑疗法,终将成为可能。
Casgevy疗法的获批,并不是旅程的终点,而是一个期待已久的开始。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


