两篇Science论文探究切尔诺贝利核电站事故中电离辐射暴露的遗传影响
来源:本站原创 2021-04-24 09:45
2021年4月24日讯/生物谷BIOON/---在两项具有里程碑意义的新研究中,来自美国、乌克兰、英国和日本的研究人员使用了前沿的基因组学工具来调查1986年乌克兰北部切尔诺贝利核电站事故中电离辐射暴露(一种已知的致癌因子)的潜在健康影响。第一项研究发现没有证据表明父母暴露于电离辐射导致新的遗传变化从父母传给孩子。第二项研究记录了那些在儿童或胎儿时期暴露于该
2021年4月24日讯/生物谷BIOON/---在两项具有里程碑意义的新研究中,来自美国、乌克兰、英国和日本的研究人员使用了前沿的基因组学工具来调查1986年乌克兰北部切尔诺贝利核电站事故中电离辐射暴露(一种已知的致癌因子)的潜在健康影响。第一项研究发现没有证据表明父母暴露于电离辐射导致的新型遗传变化从父母传给孩子。第二项研究记录了那些在儿童或胎儿时期暴露于该事故泄露的电离辐射后患上甲状腺癌的人的肿瘤中的基因变化。
这些发现是在这场灾难性事故发生35周年后发表的。这两项研究的结果均于2021年4月22日在线发表在Science期刊上,论文标题分别为“Lack of transgenerational effects of ionizing radiation exposure from the Chernobyl accident”和“Radiation-related genomic profile of papillary thyroid cancer after the Chernobyl accident”。


关于辐射对人类健康影响的科学问题自广岛和长崎的原子弹爆炸以来就一直在调查,切尔诺贝利和日本福岛海啸后的核事故再次引发了这一问题。近年来,DNA测序技术的进展使得科学家们能够开始解决一些重要的问题,部分上是通过在精心设计的流行病学研究中进行的全面基因组分析。
切尔诺贝利事故使周围地区的数百万人暴露于放射性污染物。已有研究提供了今天关于核电站事故的辐射暴露所导致的癌症的大部分知识。在此基础上,这两项新的研究利用下一代DNA测序和其他基因组表征工具,分析了受灾难影响的乌克兰人的生物样本。
第一项研究调查了一个长期存在的问题,即辐射暴露是否会导致能从父母传给后代的基因变化,正如一些动物研究表明的那样。为了回答这个问题,美国国家癌症研究所癌症流行病学与遗传学部门主任Stephen J. Chanock博士和他的同事分析了1987年至2002年期间出生的130人及其105对母亲-父亲的完整基因组。
这些父母中的一人或两人曾是帮助清理切尔诺贝利核电站事故的工人,或因居住在事故现场附近而被疏散。这些作者对每位父母长期暴露于电离辐射进行了评估,这可能是通过饮用受污染的牛奶(即在受放射性沉降物污染的牧场放牧的奶牛所产的牛奶)而发生的。这些母亲和父亲经历了一系列的辐射剂量。
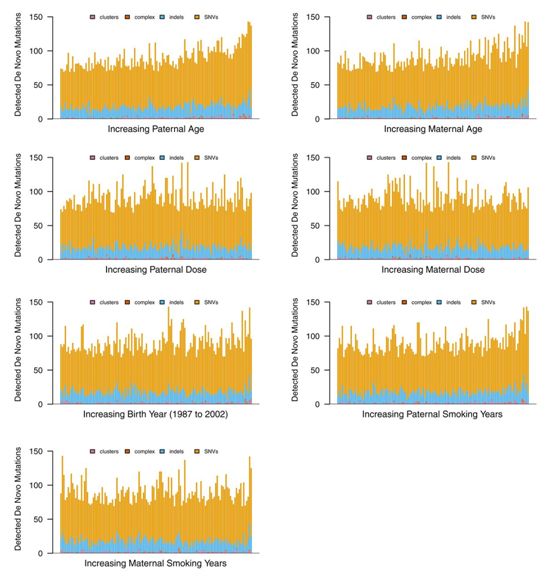
基于怀孕时父母年龄的分布检测到的每个基因组的新生突变。图片来自Science, 2021, doi:10.1126/science.abg2365。
这些作者分析了成年子女的基因组,以确定一种称为“新生突变(de novo mutation)”的特殊遗传基因变化是否增加。新生突变是在一个人的配子(精子和卵子)中随机出现的遗传变化,可以传给他们的后代,但在父母身上观察不到。
对于研究中这些父母所经历的辐射范围,全基因组测序数据没有证据表明他们在事故发生后46周至15年之间出生的孩子的新发突变的数量或类型有所增加。在这些孩子身上观察到的新发突变的数量与具有可比特征的普通人群高度相似。因此,这些研究结果表明,事故中的电离辐射对后续一代的健康影响很小(如果有的话)。
在第二项研究中,这些作者使用下一代测序技术对359名在儿童时期或在子宫内暴露于切尔诺贝利核事故泄露的放射性碘(I131)电离辐射的人以及在事故发生后9个月以上出生的81名未暴露的人中发生的甲状腺癌的基因变化进行了分析。甲状腺癌的风险增加是事故后观察到的最重要的不良健康影响之一。

440例甲状腺乳头状癌在I131辐射剂量下的体细胞改变景观。图片来自Science, 2021, doi:10.1126/science.abg2538。
电离辐射的能量打破了DNA中的化学键,导致了许多不同类型的损害。第二项研究强调了一种特殊的DNA损伤的重要性,这种损伤涉及甲状腺肿瘤中两条DNA链的断裂。DNA双链断裂和辐射暴露之间的联系对于年龄较小的儿童来说更为强烈。
接下来,这些作者确定了每个肿瘤中的候选癌症“驱动基因”,即发生改变后使癌症生长和存活的关键基因。他们在超过95%的肿瘤中确定了驱动基因。几乎所有的改变都涉及MAPK信号通路中的基因,包括BRAF、RAS和RET基因。
这组受影响的基因与以前对甲状腺癌的研究中所报告的基因相似。然而,这些作者观察到这些基因中的突变类型的分布发生了变化。具体来说,在第二项研究中,儿童时期暴露于较高辐射剂量的人发生的甲状腺癌更有可能是由基因融合(当DNA的两条链被破坏,然后错误的DNA片段被重新连接在一起)导致的,而未暴露于辐射的人或暴露于低水平辐射的人更有可能是由点突变(基因的一个关键部分发生的单碱基对变化)导致。
这些结果表明DNA双链断裂可能是暴露于环境中电离辐射后的一种早期遗传变化,这种变化随后让甲状腺癌生长。这些作者补充说,他们的发现为进一步研究辐射诱发的癌症提供了基础,特别是那些涉及与剂量和年龄相关的风险差异的研究。
这些作者表示,第二项研究的一个令人兴奋的方面是有机会将肿瘤的基因组特征与辐射剂量---可能导致癌症的风险因素---的信息联系起来。癌症基因组图谱(Cancer Genome Atlas)为如何全面描述肿瘤特征设定了标准。他们扩增了这一方法,完成了第一个针对已被很好描述的潜在致癌因子暴露的大型基因组景观研究,从而使得人们能够调查特定肿瘤特征和辐射剂量之间的关系。
他们指出这两项研究之所以成为可能,是因为大约20年前切尔诺贝利组织库(Chernobyl Tissue Bank)的建立,这使得他们可以开展如今很常见的基因组和分子研究,而这在当时是不可能进行的。这两项研究代表了这些作者首次使用他们在乌克兰之前收集的生物样本进行分子研究。切尔诺贝利组织库是由有远见的科学家建立的,旨在收集来自高度污染地区的患上甲状腺癌的居民的肿瘤样本。这些科学家意识到未来的技术会有实质性的进步,而研究界如今正受益于他们的远见卓识。(生物谷 Bioon.com)
参考资料:
Meredith Yeager et al. Lack of transgenerational effects of ionizing radiation exposure from the Chernobyl accident. Science, 2021, doi:10.1126/science.abg2365.
Lindsay M. Morton et al. Radiation-related genomic profile of papillary thyroid cancer after the Chernobyl accident. Science, 2021, doi:10.1126/science.abg2538.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


