Cell子刊:颜宁团队提出用于钠和钾离子通道的通用残基编号方案
来源:生物世界 2024-09-07 10:19
在这篇综述中,颜宁等人为Nav和Cav通道引入了一种通用的残基编号方案,该方案标注了氨基酸残基在结构片段内的位置,从而统一了参与重要基序(如选择性过滤器和跨膜片段)的氨基酸残基。
颜宁等人在 Cell Press 旗下期刊 Cell Chemical Biology 上发表了题为:A versatile residue numbering scheme for Nav and Cav channels 的观点文章。
颜宁等人提出了一种基于结构的残基编号方案,以每个功能区段上最保守的残基为中心,通过说明性示例详细阐述了通用编号,重点关注真核生物Nav和Cav通道的代表性药物结合位点。他们还扩展了编号方案,以比较不同Nav亚型之间常见的疾病突变。通用残基编号方案的应用能够立即洞察致病突变的热点和药物结合的关键位点,还将促进靶向Nav和Cav通道的药物发现。

电压门控钠(Nav)通道和电压门控钙(Cav)通道在电信号传导中发挥关键作用。Nav通道对于动作电位的产生和传递不可或缺。Cav通道将细胞膜去极化与钙离子内流相耦合,从而调节各种生理过程(例如肌肉收缩、分泌、神经传递和基因表达)。
Nav通道和Cav通道都属于电压门控离子通道(VGIC)超家族,该超家族还包括Kv通道、瞬时受体电位(TRP)通道和兰尼碱受体(RyR)。最初,对于众多的离子通道同工型缺乏标准化的命名法,对它们的描述是基于定位、电生理特性以及对毒素和药物的反应。1991 年,George Chandy教授根据系统发育分类为Kv通道提出了一种数字注释的命名法。随后,针对Nav通道和Cav通道的类似命名法也被提了出来。这种标准化的命名系统,将Nav通道命名为Nav1.1 - Nav1.9 共9个亚型,将Cav通道命名为Cav1.1 - Cav1.4、Cav2.1 - Cav2.3 和 Cav3.1 - Cav3.3 共10个亚型,这对科学教育、交流和合作的帮助非常大。
由于Nav通道和Cav通道在生理中的基础重要性,它们的功能障碍或异常调控与各种疾病相关。例如,Nav1.1的编码基因SCN1A包含与不同形式癫痫发作相关的数百种突变,使其成为癫痫的一个易患病风险因素。在长QT综合征3型(LQT3)患者中发现了许多Nav1.5的功能增益(GOF)突变,这是一种以心室复极化延长为特征的主要的心律失常形式。另一方面,Nav1.5的的数百种功能缺失突变(LOF)与Brugada综合征有关。Nav1.7的功能增益突变或无义突变分别与红斑性肢痛症或先天性痛觉不敏感相关。因此,Nav通道已成为心律失常、癫痫和疼痛的治疗靶点。Cav通道也是如此,Cav阻滞剂,例如二氢吡啶(DHP)、苯烷基胺(PAA)和苯并噻氮卓类(BTZ),几十年来已被广泛用于治疗心血管疾病和其他疾病。Cav2.2和Cav3通道正成为开发下一代止痛药的靶点。
此前已有大量的文献和综述文章很好地总结了Nav通道和Cav通道的研究历史、分类和病理/生理学。颜宁等人最近也就Nav通道和Cav通道的结构生物学和结构药理学的研究进展发表了几篇综述。在撰写这些综述文章的过程中,他们意识到一个主要的不便之处——当涉及到特定氨基酸残基的描述时,相同的位点在不同物种的不同亚型以及可变剪接变体中具有不同的残基数。这种差异可能会阻碍有效利用大量可用的Nav通道和Cav通道结构来建立结构-功能关系。
受到用于G蛋白偶联受体(GPCR)的 Ballesteros-Weinstein 编号方案(其中保守残基被设定为基准)的启发,颜宁等人呼吁为Nav通道和Cav通道建立一个通用残基编号方案。在这篇文章中,他们介绍了暂定的编号系统,并通过药物结合位点和致病性突变的说明性案例对该编号进行了详细阐述。

从左至右依次为:靳雪琴博士(颜宁实验室助理研究员)、颜宁教授(深圳医学科学院创始院长、深圳湾实验室主任、清华大学教授)、王欢(颜宁实验室博士后)
图1为真核生物Nav和Cav通道的基于结构的通用残基编号系统的拓扑结构和概述。(A):真核生物Nav和Cav通道的拓扑结构,核心亚基(Nav通道中的α和Cav通道中的α1)在跨膜区域具有相同的拓扑结构,包含四个重复序列——I-IV。Nav通道可能与一个或两个β亚基复合,Cav1和Cav2亚型与细胞外的α2δ亚基和细胞内的β亚基相关联。重复编码的配色方案适用于所有图形。(B-D):真核生物Nav和Cav通道的代表性结构,此处展示的是与β1和β2亚基复合的人Nav1.7(B)、兔Cav1.1复合物(C)和人Cav3.1(D)。Cav1和Cav2通道与多个辅助亚基共同发挥作用,Cav3亚型(Cav3.1-Cav3.3)与它们不同,其功能不依赖于任何辅助亚基。(E)Nav或Cav通道中一个重复的拓扑结构上通用残基数编号系统的图示,在每个S1-S6和P1-SF-P2片段的中间,一个不变的残基(表示为粉色圆圈)被选为通用编号系统中的基准,并进行编号。(F)具有新编号系统的基准残基的结构映射,几个药物结合位点在粉色圆圈中用单个字母表示,以显示它们相对于基准残基的位置。位点S:选择性过滤器(Selectivity filter);位点C:腔(Cavity);位点F:膜内开口(Fenestration);位点V4EC:VSDIV中的细胞外腔。(G-H)选择性过滤器基序残基,Nav通道中的DEKA(天冬氨酸/谷氨酸/赖氨酸/丙氨酸)、Cav1和Cav2中的EEEE(谷氨酸/谷氨酸/谷氨酸/谷氨酸)以及Cav3中的EEDD(谷氨酸/谷氨酸/天冬氨酸/天冬氨酸),都用通用方案中定义的残基数进行标记。结合的Na +和Ca2+离子分别在(C)和(D)中显示为蓝色和黄色球体。
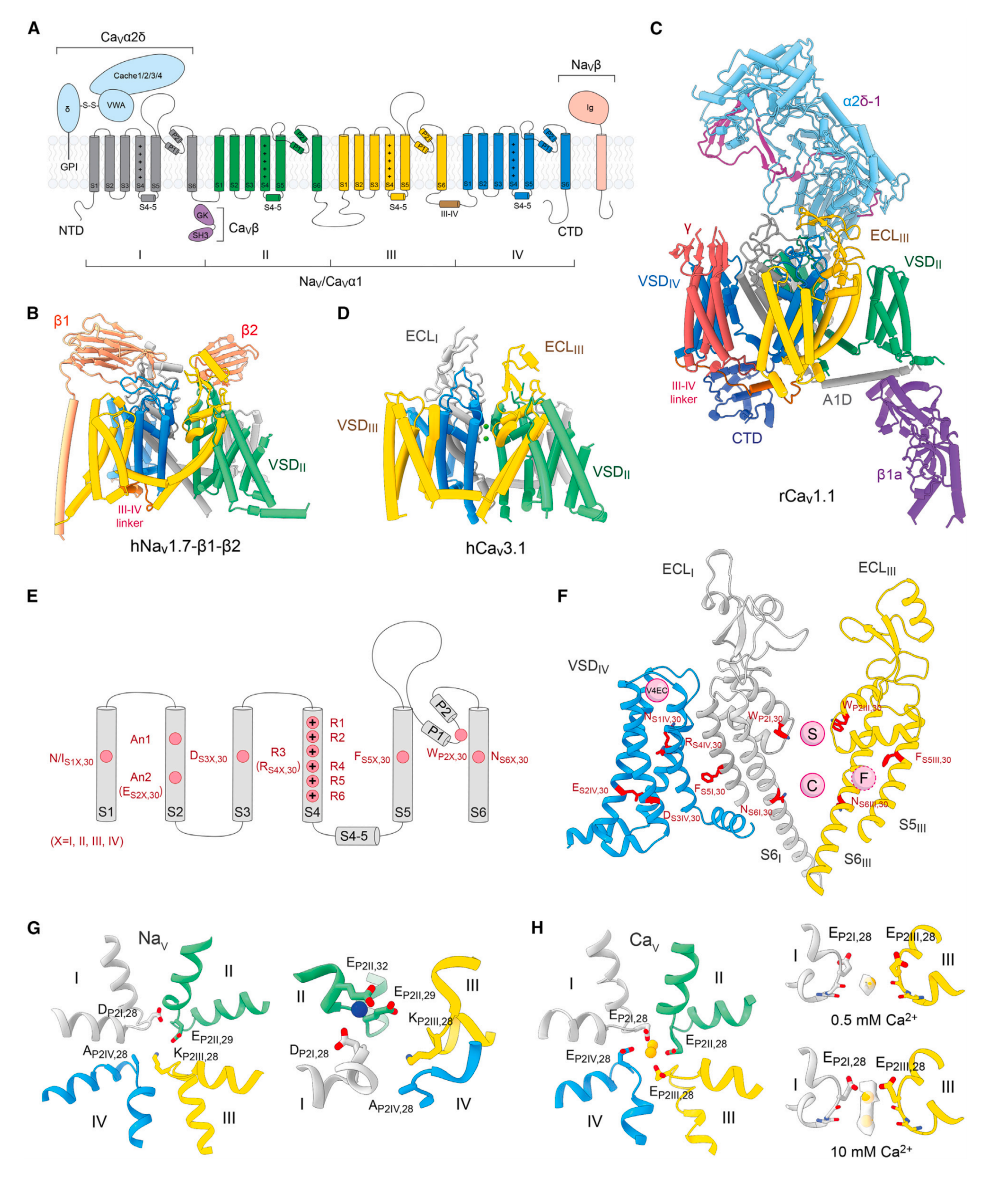
图1:真核生物Nav和Cav通道基于结构的通用残基编号系统的拓扑结构和概述
离子通道在药物开发的靶蛋白类别中位列第三(仅次于GPCR、核受体),约有150种与离子通道相关的新药正在进行临床前和临床研究。确定电压门控离子通道(VGIC)中的药物结合和突变热点残基将增进我们对药物作用模式的理解,并促进靶向这些通道的药物发现,而残基数不同会带来不便。在这篇综述中,颜宁等人为Nav和Cav通道引入了一种通用的残基编号方案,该方案标注了氨基酸残基在结构片段内的位置,从而统一了参与重要基序(如选择性过滤器和跨膜片段)的氨基酸残基。
通用残基编号系统有效地促进了跨物种和通道亚型的热点残基、突变效应以及药物结合位点的比较。使用通用编号系统时,Nav和Cav通道之间药物结合位点的保守性和差异性会立即显现出来。此类注释的残基数对于人工智能(AI)辅助的药物结合口袋预测和药物设计将特别有用,使AI算法能够无缝对齐和分析来自不同物种的不同亚型和剪接变体的功能序列。AI模型可能会利用这一标准化框架来预测疾病易感性、药物疗效或耐药性,从而有利于个性化医疗。
受GPCR编号系统的启发,该文章提出了Nav和Cav通道的通用编号系统,其实用性有待研究社区的评估,并可能在未来扩展到其他电压门控离子通道(VGIC)家族,例如瞬时受体电位(TRP)通道和电压门控钾(Kv)通道。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


