JITC:中山大学李俊东教授团队找到对抗晚期子宫内膜癌的“中国组合”!
来源:奇点糕 2022-07-04 14:48
与大多数其他妇科恶性肿瘤的发病率下降不同,子宫内膜癌(EC)的发病率和死亡率在发达国家和中国均有所增加。
与大多数其他妇科恶性肿瘤的发病率下降不同,子宫内膜癌(EC)的发病率和死亡率在发达国家和中国均有所增加[1]。一线化疗后进展的患者临床治疗选择有限,预后差,中位总生存期仅为1年左右[2];目前的二线疗法抗肿瘤活性有限,对于一线治疗后进展的患者,临床尚无标准治疗方案。
而国产抗癌创新药或许能成为新的希望,例如国产免疫治疗药物的代表——PD-1抑制剂信迪利单抗,以及多靶点抗血管生成药物安罗替尼[3],这两款药物联合应用于多种实体瘤的临床研究正在进行中,也报告了不少积极的结果[4]。
近日,中山大学附属肿瘤医院李俊东教授团队发起的一项开放标签、单臂、II期临床研究,首次在中国人群中,探讨了信迪利单抗联合安罗替尼用于复发或晚期子宫内膜癌的疗效和安全性,并通过高通量测序技术探索了可用于预测疗效的生物标记物。研究结果发表于免疫治疗领域著名期刊《癌症免疫治疗杂志》。
研究显示,接受信迪利单抗联合安罗替尼治疗的复发或晚期子宫内膜癌患者,客观缓解率(ORR)和疾病控制率(DCR)分别为73.9%和91.3%;中位随访时间为15.4个月,中位无进展生存期(PFS)未达到,PFS≥12个月的概率为57.1%。探索性分析表明,存在同源修复途径基因突变的患者显示出较高ORR的趋势[5]。

论文首页信息
这项研究纳入的是至少接受过一种铂基化疗后复发或晚期子宫内膜癌患者,研究采用Simon-s最优两阶段设计,在第一阶段7名患者中,如果有2名或更多患者出现响应,将在第二阶段额外招募15(实际招募了16)名患者(共23名)。
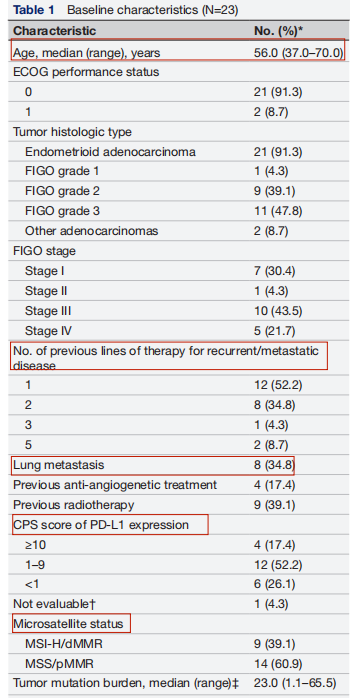
纳入患者的基线特征
入组患者每3周为一个治疗周期,在每个周期的第1天静脉注射200mg信迪利单抗,在第1-14天每天口服12mg安罗替尼。治疗持续到疾病进展、无法耐受的毒性、撤回同意。在第3和第5个周期开始前,通过CT或MRI评估肿瘤反应,然后前11个周期每三个周期评估一次,第11个周期之后每四个周期评估一次。
研究的主要终点是客观缓解率(ORR);次要终点包括疾病控制率(DCR)、缓解持续时间(DOR)、无进展生存期(PFS)、反应时间(TTR)、临床获益率(CBR)和安全性。
截至本次研究报告时,患者的中位随访时间为15.4个月(95%CI,12.6-18.3)。截止2021年9月30日,10名患者正在接受治疗,13名(56.5%)患者停止治疗,其中5名患者在随访期间死亡。
接下来,我们看看这项试验的主要结果。
第一阶段招募的7名患者中,有6名(85.7%)患者达到经确认的客观缓解,Simon-s两阶段第一阶段的ORR阈值已经达到。至本次报告截止时,达到完全缓解(CR)、部分缓解(PR)、病情稳定(SD)、疾病进展(PD)的患者分别有4例(17.4%)、13例(56.5%)、4例(17.4%)和2例(8.7%)。
研究者根据irRECIST(实体瘤免疫相关反应评价标准)评估的ORR(全部确认)为73.9%(95%CI,51.6%-89.8%),24周时的ORR为65.2%(95%CI,42.7%-83.6%);DCR和CBR分别为91.3%(95%CI,72.0%-98.9%)和69.6%(95%CI,47.1%-86.8%)。
值得注意的是,4例CR患者中有3例为原发性铂耐药患者,这类患者肿瘤侵袭性往往更强;17例缓解的患者中有8例(47.1%)曾接受过多线化疗。
在治疗反应时间方面,本研究显示的治疗效果快速且持久,中位TTR为2.8个月(95%CI,1.5-5.2)。虽然中位随访时间为15.4个月时未达到PFS和DOR,但PFS>6个月和>12个月的概率分别为76.7%(95%CI,52.7%-89.6%)和57.1%(95%CI,33.6%-75.0%)。此外,45.5%(10/22)患者的肿瘤达到了50%以上的减小。
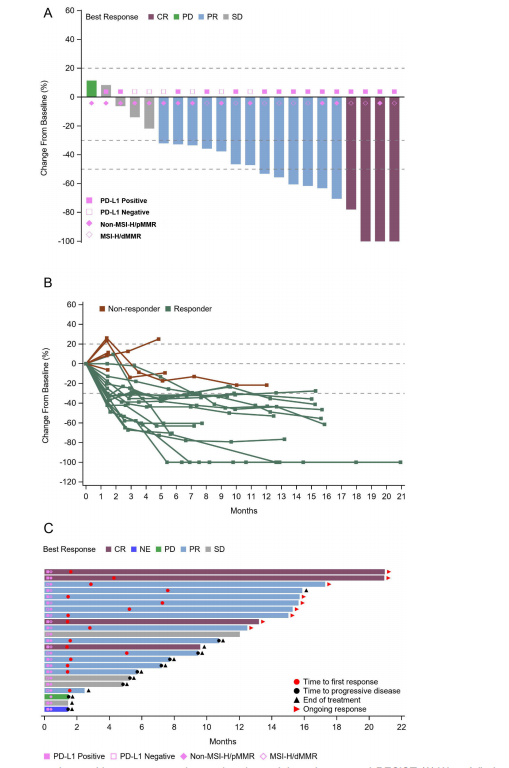
A:靶病灶直径之和相对于基线时的最大变化百分比;B:肿瘤大小相对于基线时的纵向变化;C:客观反应和持续时间
事后分析显示,MSI-H/dMMR患者的ORR高于MSS/pMMR患者(100% vs 57.1%,p=0.048),且中位PFS也相对更长,MSS/pMMR与MSI-H/dMMR患者相比,疾病进展或死亡风险增加了1.96倍(95%CI,1.04-8.40;p=0.04)。
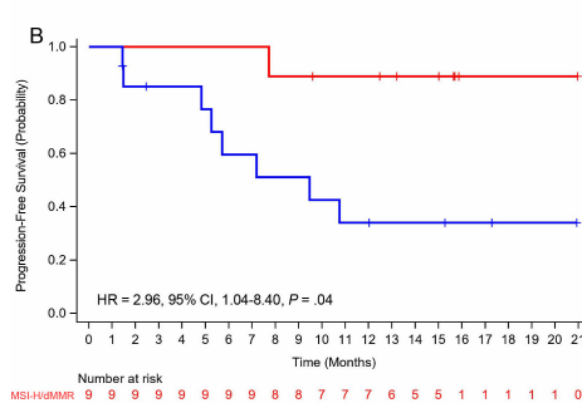
无进展生存的Kaplan-Meier图
安全性分析显示,所有患者都经历过任何级别的不良事件,最常见的是掌跖红斑感觉异常综合征(PPE)/皮疹和甲状腺功能减退。虽然3/4级治疗相关不良事件发生率为50%,但大多数患者无需住院即可控制;严重不良事件发生率为17.4%,未发生治疗相关死亡。有2名患者停用了信迪利单抗和安罗替尼,1名患者仅停用了安罗替尼,中位治疗周期为15(2-28)。
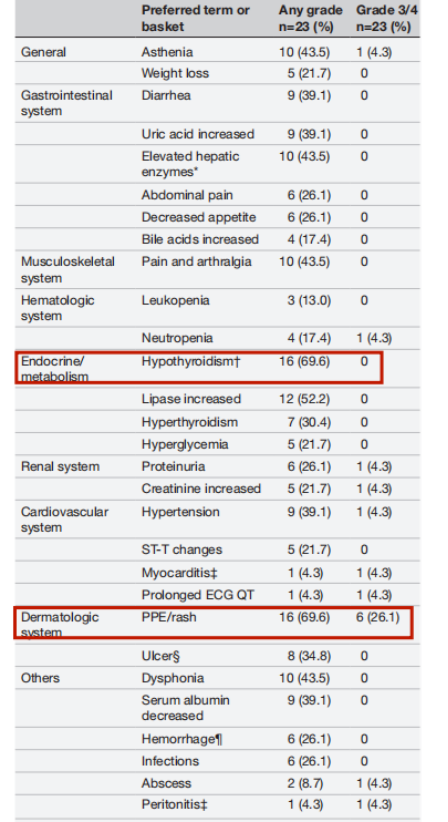
治疗相关不良事件
最后,研究人员对21例患者的肿瘤组织进行全基因组和单基因测序;单基因测序结果显示,没有单个靶基因的突变与ORR相关。全基因组测序结果显示,存在同源修复(HR)途径基因突变的患者显示出较高ORR的趋势(100% vs 0%,p=0.07)。
此外,存在HR(80% vs 30%,p=0.03)或错配修复(MMR)通路突变(80% vs 10%,p=0.01)的患者,在试验中肿瘤减少>50%的比例更高;其他参与DNA修复的途径,如碱基切除修复和非同源末端连接途径,与ORR无关。肿瘤组织的全外显子组测序(WES)结果则显示,肿瘤新生抗原与治疗反应相关,而肿瘤内异质性(ITH)水平与治疗反应无关。
那么有哪些基因的突变会影响PFS呢?
分析显示,酪氨酸蛋白激酶Lyn(Lyn)基因突变与PFS降低相关(6.5vsNA,p=0.007);肿瘤突变负荷(TMB)高和HR途径突变(HRmut)患者的PFS显著长于TMB低或HR途径野生型(HRwt)患者(NE vs 10.1个月,p=0.03),值得一提的是,这是首次在临床试验中证实在EC患者中HR途径突变对抗肿瘤活性有积极贡献。在上述遗传特征中,Cox回归未发现具有显著差异的单一因素。
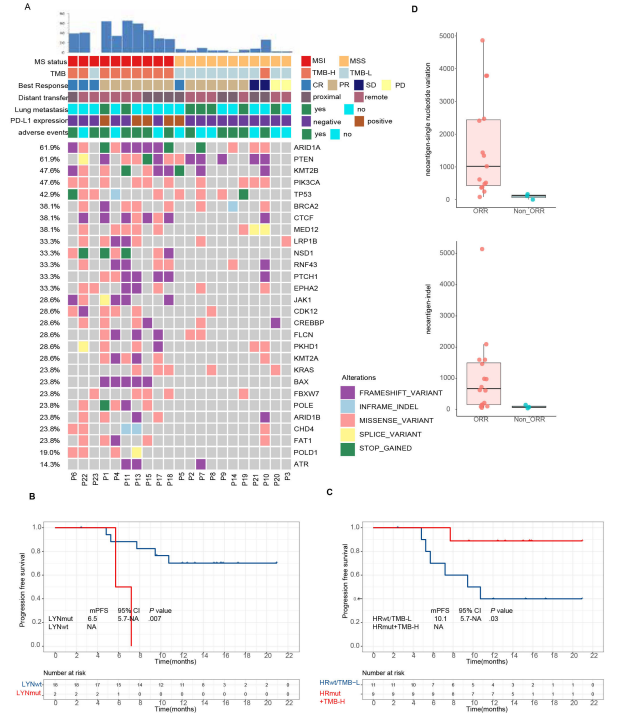
肿瘤组织高通量测序探索性分析相关生物标志物
既往研究表明,PD-1抑制剂单药治疗在伴有MSI-H/dMMR的EC患者中ORR在42.3%-57.1%之间[7],但大多数未伴有MSI-H/dMMR的EC患者ORR小于20%,疗效并不理想。而在这项研究中,不管患者微卫星状态(MS)如何,信迪利单抗联合安罗替尼均显示出了良好的治疗效果。
本次研究结果也与先前报道的抗血管生成药物+PD-1抑制剂,二线联合治疗EC患者的结果基本一致,如仑伐替尼联合帕博利珠单抗在KEYNOTE-146研究中,治疗24周的ORR为38.0%,中位PFS为7.4个月[7];在KEYNOTE-775研究中,该组合对比化疗的中位PFS分别为7.2 vs 3.8个月,中位OS分别为18.3 vs 11.4个月[8]。
值得注意的是,在这项研究中,MSS/pMMR患者的ORR为57.1%,这表明安罗替尼可显著提高MSS/pMMR EC患者对PD-1抑制剂的敏感性。结合仑伐替尼联合帕博利珠单抗的结果,这进一步证实PD-1抑制剂与抗血管生成药物联合,治疗复发/晚期EC患者的疗效良好。
总的来说,这项研究表明,信迪利单抗联合安罗替尼显示出强大的抗肿瘤活性。这种治疗方案对一线化疗后进展的EC患者是一种很有希望的治疗方法。这项研究小样本量和单臂设计使其存在一定的局限性,该方案的有效性和安全性应在明确的随机研究中进行验证。
参考文献:
1.Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015. CA Cancer J Clin. 2016;66(2):115-132. doi:10.3322/caac.21338
2.Morice P, Leary A, Creutzberg C, Abu-Rustum N, Darai E. Endometrial cancer. Lancet. 2016;387(10023):1094-1108. doi:10.1016/S0140-6736(15)00130-0
3.Sun Y, Du F, Gao M, et al. Anlotinib for the Treatment of Patients with Locally Advanced or Metastatic Medullary Thyroid Cancer. Thyroid. 2018;28(11):1455-1461. doi:10.1089/thy.2018.0022
4.Chu T, Zhong R, Zhong H, et al. Phase 1b Study of Sintilimab Plus Anlotinib as First-line Therapy in Patients With Advanced NSCLC. J Thorac Oncol. 2021;16(4):643-652. doi:10.1016/j.jtho.2020.11.026
5.Wei W, Ban X, Yang F, et al. Phase II trial of efficacy, safety and biomarker analysis of sintilimab plus anlotinib for patients with recurrent or advanced endometrial cancer. J Immunother Cancer. 2022;10(5):e004338. doi:10.1136/jitc-2021-004338
6.Oaknin A, Tinker AV, Gilbert L, et al. Clinical Activity and Safety of the Anti-Programmed Death 1 Monoclonal Antibody Dostarlimab for Patients With Recurrent or Advanced Mismatch Repair-Deficient Endometrial Cancer: A Nonrandomized Phase 1 Clinical Trial. JAMA Oncol. 2020;6(11):1766-1772. doi:10.1001/jamaoncol.2020.4515
7.Makker V, Taylor MH, Aghajanian C, et al. Lenvatinib Plus Pembrolizumab in Patients With Advanced Endometrial Cancer. J Clin Oncol. 2020;38(26):2981-2992. doi:10.1200/JCO.19.02627
8.Makker V, Colombo N, Casado Herráez A, et al. Lenvatinib plus Pembrolizumab for Advanced Endometrial Cancer. N Engl J Med. 2022;386(5):437-448. doi:10.1056/NEJMoa2108330
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


