《细胞》子刊:快乐抗癌有道理!中国科学家发现,5-羟色胺能增强CD8阳性T细胞抗肿瘤免疫
来源:奇点糕 2024-03-09 08:55
这项研究深入探究了5-HT在CD8+T细胞激活中的作用,提出了GAPDH的5-HT化修饰促进GAPDH胞内转移,增强糖酵解代谢,进而促进CD8+T细胞免疫活性的新机制。
5-羟色胺(5-HT)是一种重要的神经递质,也被称为血清素。它能帮助我们感受愉悦,还能调节睡眠、食欲、疼痛感知等多种功能。
近年来,有研究发现5-HT可以直接促进肿瘤细胞的生长和侵袭[1],有趣的是,也有研究发现它还能直接作用于肿瘤微环境中的免疫细胞而发挥效应[2]。然而,5-HT调控CD8+T细胞抗肿瘤免疫的具体机制尚不清楚。
近日,上海交通大学医学院附属仁济医院张志刚团队,联合江苏大学附属医院肿瘤研究院放疗科王旭团队,在Molecular Cell杂志发表研究成果[3],揭示了5-HT促进CD8+T细胞的糖酵解代谢和抗肿瘤免疫活性的分子机制。
他们发现,激活的CD8+T细胞通过色氨酸羟化酶1(TPH1)的内源性生成和5-HT转运体(SERT)的胞外摄取,来积累细胞内5-HT;随后,在转谷氨酰胺酶2(TGM2)的催化下,甘油醛-3-磷酸脱氢酶(GAPDH)发生5-HT化修饰,促进GAPDH从核内向胞质转移,从而增强糖酵解代谢,进而促进了CD8+T细胞的激活和抗肿瘤免疫活性。

论文首页截图
研究者们首先进行了体外研究,发现5-HT可以促进CD8+T细胞的增殖,增加干扰素-γ(IFN-γ)的释放。RNA测序结果也提示,5-HT可以增加CD8+T细胞激活相关基因的表达。
这说明了5-HT确实能够激活CD8+T细胞,那么是通过什么方式激活的呢。考虑到近年来有研究发现5-HT可以通过5-HT化调节蛋白质的功能,因此研究人员想知道是不是5-HT化在发挥作用。
研究者发现,在5-HT的刺激下可能发生5-HT化的蛋白中,有多个跟糖酵解密切相关,其中仅有GAPDH的活性在刺激下增加,这提示GAPDH是5-HT化的底物。而随着GAPDH水平升高,CD8+T细胞的糖酵解代谢也随之增加。说明GAPDH可能通过增强糖酵解代谢而促进CD8+T细胞的激活。
转谷氨酰胺酶2(TGM2)是催化5-HT化修饰的关键酶,当TGM2被敲除时,5-HT对GAPDH的刺激效果降低,导致糖酵解代谢也受到抑制。此外,使用GAPDH和糖酵解的抑制剂均能够阻断CD8+T细胞的增殖和IFN-γ的产生。
到这里,5-HT激活CD8+T细胞的机制初现雏形:TGM2催化GAPHD的5-HT化修饰,增强糖酵解代谢,进而促进了CD8+T细胞激活和抗肿瘤免疫活性。
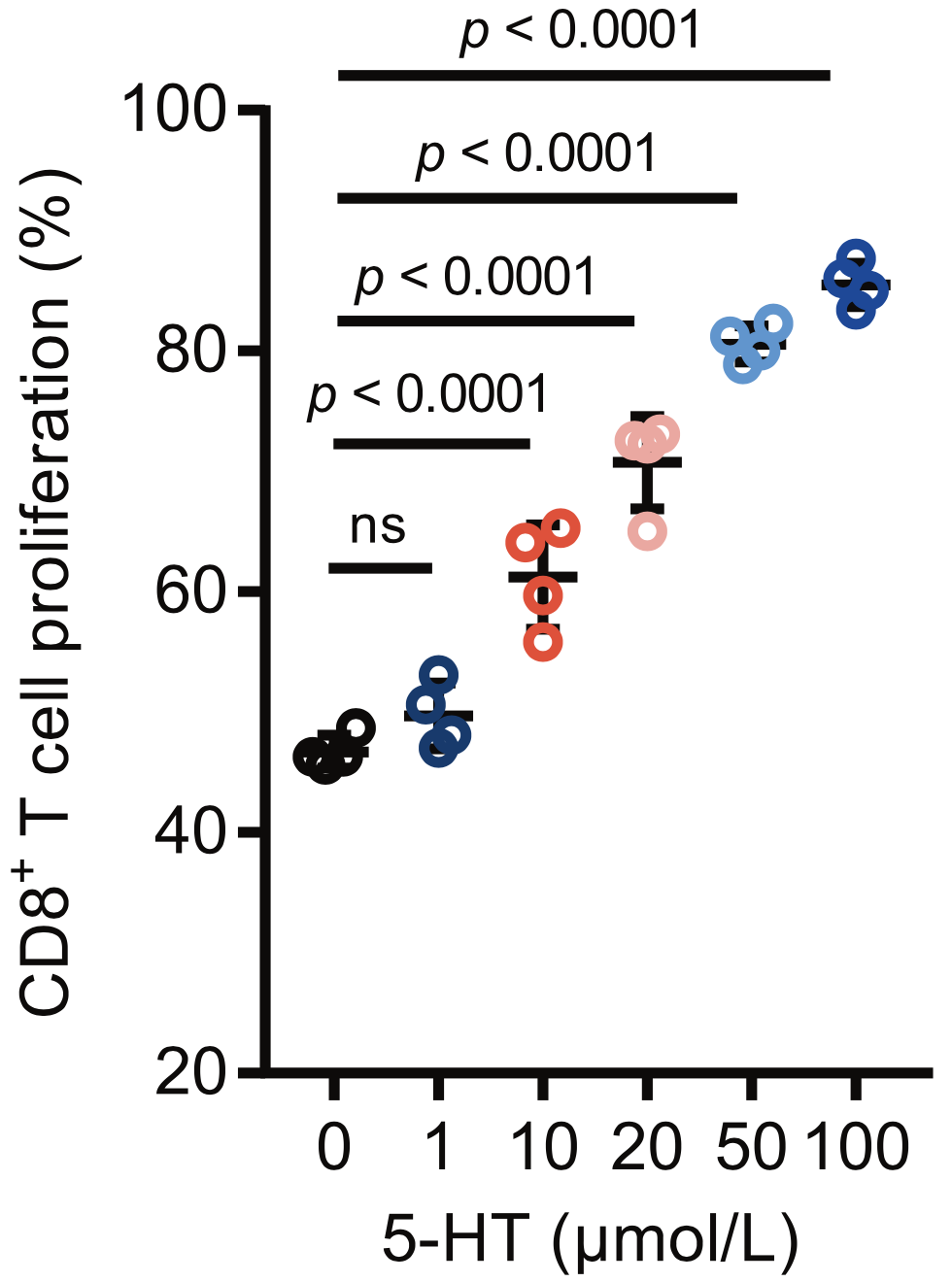
5-HT促进CD8+T细胞激活
那么GAPDH发生5-HT化修饰的具体位点是什么?GAPDH发生5-HT化后为什么能增强活性从而促进糖酵解代谢?
5-HT化修饰需要Gln残基,GAPDH上有5个Gln位点可以发生5-HT化修饰。使用完整长度的GADPH蛋白的分析显示,Gln183和Gln262是5-HT化反应的底物。研究者注意到Gln262位于GAPDH的核输出序列(NES),它能将GAPDH从核内转移到胞质,有助于增强GADPH的活性。
Gln262是修饰的具体位点吗?GAPDH的胞质内定位是增强糖酵解的关键吗?
进一步质谱分析发现Gln262位点是TGM2催化的5-HT化修饰的直接底物。为了更好的表征CD8+T细胞中的5-HT化修饰,研究者制备了能特异性识别Gln262 5-HT化修饰位点(Gln262ser)的抗体,使用免疫印迹、共聚焦显微镜和流式均观察到了CD8+T细胞GAPDH Gln262ser的修饰。
在共聚焦显微镜下,还观察到在初始CD8+T细胞中,GAPDH主要分布在细胞核,而在激活的CD8+T细胞中,不少GAPDH分布到了细胞质,5-HT可以进一步促进GAPDH向细胞质转移。而在不发生5-HT化的CD8+T细胞中,即使有5-HT的刺激,GAPDH向胞质的转移也并不增加。
为了进一步探讨5-HT化如何调控GAPDH的活性,研究者构建了GAPDH Gln位点突变型细胞,结果发现只有Q262A位点突变会抑制GAPDH的活性。并且Q262A突变型细胞在5-HT的刺激下,也不会出现明显的GAPDH向胞质的转移,同时糖酵解代谢水平下降。
以上结果说明GAPDH的262位点是其5-HT化修饰的具体位点,并且修饰后会促进GAPDH向细胞质内转移,增强GAPDH活性,从而增强糖酵解代谢,进而激活CD8+T细胞。
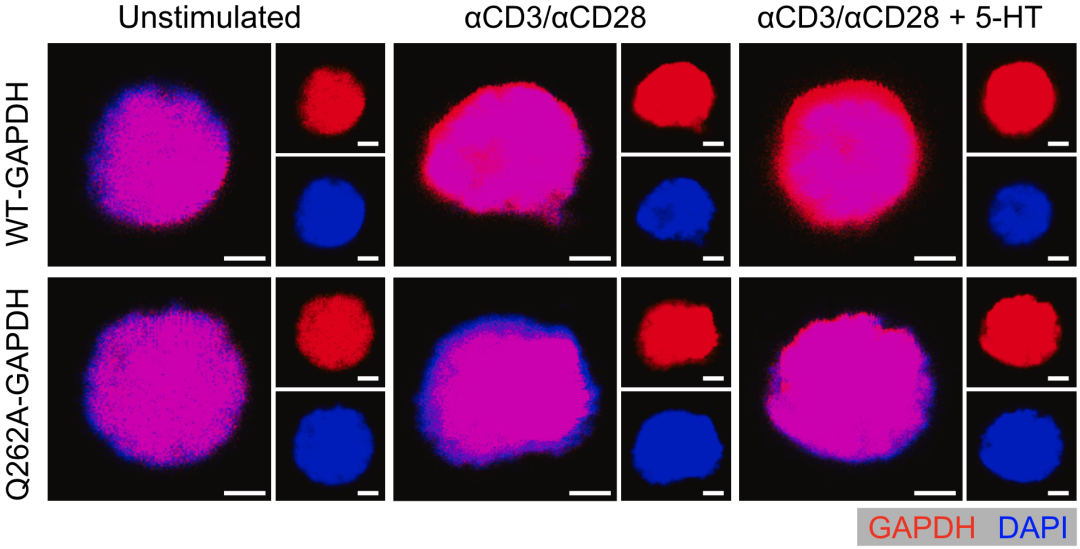
GAPDH的5-HT化促进其在CD8+T细胞中的胞质定位和糖酵解活性
5-HT化修饰反应需要有足够的5-HT,那5-HT是从哪来的呢?
RNA测序和PCR结果显示,初始CD8+T细胞几乎不表达5-HT合成酶(TPH1或TPH2),而活化的CD8+T细胞中TPH1的表达显著增加。此外,还发现5-HT转运体(SERT)在CD8+T细胞中也大量表达。这些发现提示CD8+T细胞可能通过色氨酸羟化酶1(TPH1)的内源性生成和5-HT转运体(SERT)的胞外摄取,这两条途径来积累细胞内5-HT。
研究者构建了TPH1缺失的CD8+T细胞和SERT缺失小鼠证实了上述推论,他们发现与野生型相比,TPH1或SERT的缺失,抑制了5-HT的积累,并且降低了细胞增殖和IFN-γ水平。
研究者还发现在CD8+T细胞中,5-HT仍然可以通过经典途径,与5-HT受体结合来促进CD8+T细胞的激活,但是通过这一途径的激活效果在刺激1天后就出现下降,3-5天后进一步下降。与之相对比,5-HT化修饰这一路径的激活效果在刺激5天后仍然维持,这提示GAPDH的5-HT化修饰才是CD8+T细胞能够长时间激活的关键。
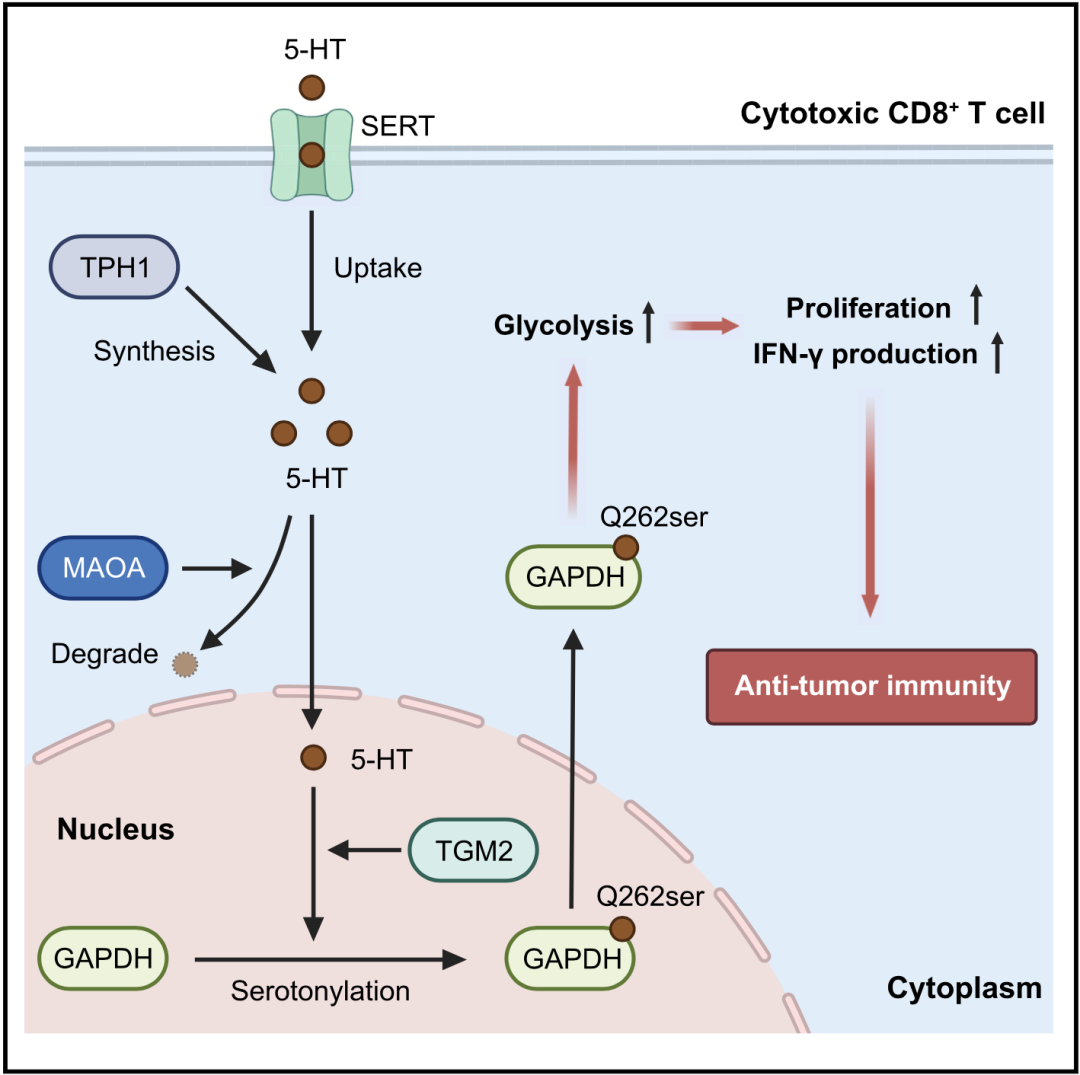
机制示意图
接下来研究者们探索了5-HT的降解途径。单胺氧化酶包括MAOA、MAOB,可以催化5-HT的降解。初始CD8+T细胞中表达了MAOA,而在激活后,表达进一步上调。
研究者构建了MAOA敲除小鼠,体外研究中发现,MAOA缺失CD8+T细胞的5-HT含量显著升高,GAPDH的胞质内定位增加,糖酵解代谢增强,细胞增殖和IFN-γ水平增加。免疫印迹结果证实,在MAOA缺失的细胞中,GAPDH Gln262ser的5-HT化增强,并且这一过程可以被TGM2抑制剂阻断。
体内研究中也进一步证实了以上结论。MAOA缺失小鼠的瘤内CD8+T细胞显著增加,并且IFN-γ也升高。这些实验结果证实,MAOA通过降解细胞内5-HT而抑制GAPDH的5-HT化修饰,从而抑制CD8+T细胞的激活。
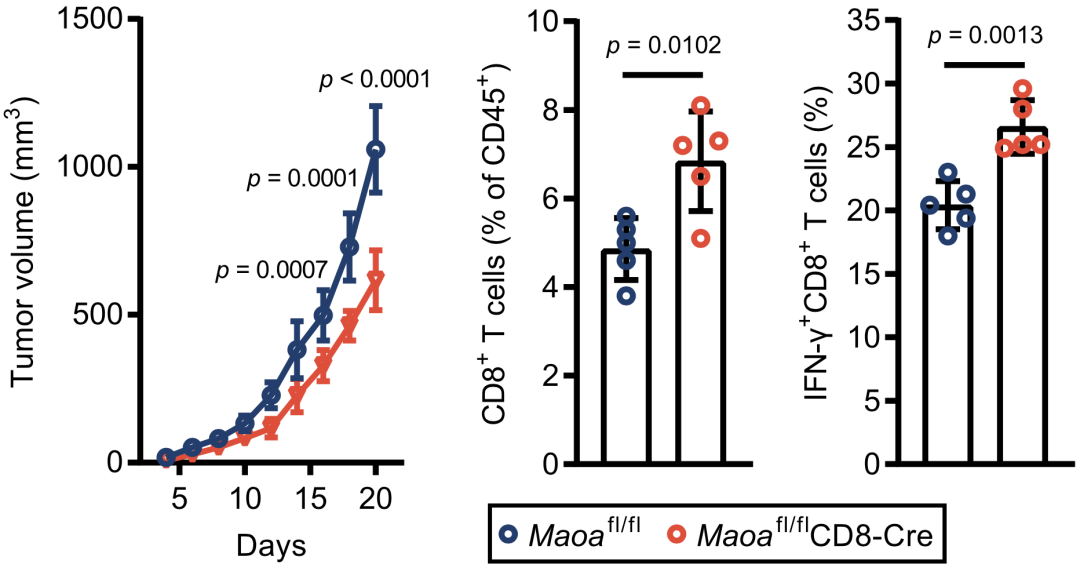
MAOA降解5-HT抑制GAPDH的5-HT化,降低CD8+T细胞抗肿瘤活性
最后,研究者们设计了过表达TPH1的CAR-T细胞,来评估CD8+T细胞的5-HT化修饰在肿瘤免疫治疗中的潜力。
结果发现,过表达THP1的CAR-T细胞中5-HT水平增加,GAPDH Q262ser的5-HT化修饰表达上调,细胞增殖增加,IFH-γ升高。动物实验表明,传统CAR-T治疗在23天时肿瘤缩小32%,而TPH1-CAR-T治疗肿瘤缩小可达78%,表明了TPH1-CAR-T细胞具有强大的抗肿瘤免疫活性。
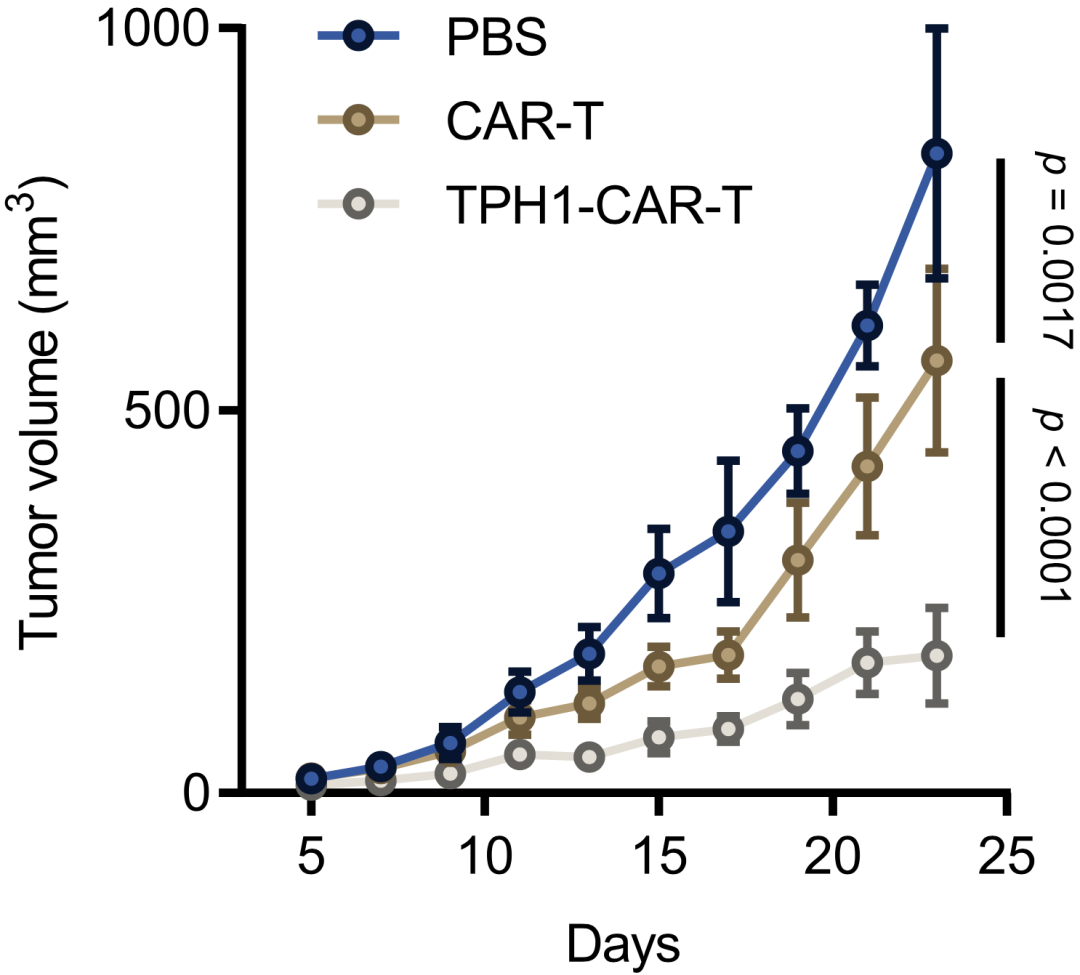
过表达TPH1的CAR-T细胞可产生5-HT来增强抗肿瘤活性
总的来说,这项研究深入探究了5-HT在CD8+T细胞激活中的作用,提出了GAPDH的5-HT化修饰促进GAPDH胞内转移,增强糖酵解代谢,进而促进CD8+T细胞免疫活性的新机制,为肿瘤的治疗增加了一个有潜力的靶点。
参考文献:
[1] Jiang SH, Li J, Dong FY, et al. Increased Serotonin Signaling Contributes to the Warburg Effect in Pancreatic Tumor Cells Under Metabolic Stress and Promotes Growth of Pancreatic Tumors in Mice. Gastroenterology. 2017;153(1):277-291.e19. doi:10.1053/j.gastro.2017.03.008
[2]Schneider MA, Heeb L, Beffinger MM, et al. Attenuation of peripheral serotonin inhibits tumor growth and enhances immune checkpoint blockade therapy in murine tumor models. Sci Transl Med. 2021;13(611):eabc8188. doi:10.1126/scitranslmed.abc8188
[3] Wang X, Fu SQ, Yuan X, et al. A GAPDH serotonylation system couples CD8+T cell glycolytic metabolism to antitumor immunity. Mol Cell. 2024;84(4):760-775.e7. doi:10.1016/j.molcel.2023.12.015
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


