间充质干细胞分泌细胞外小泡可促进小鼠局灶性脑缺血后脑血管生成、脑重塑和神经功能恢复
来源:本站原创 2021-06-17 09:54
来源于右侧细胞类型的间充质基质细胞(MSC)来源的小细胞外小泡(SEV)可促进中风的康复。在这一过程中,微血管重塑起着核心作用。因此,作者研究了MSCsEVs对体外培养的人脑微血管内皮细胞(hCMEC/D3)增殖、迁移和管状形成的影响,以及对小鼠大脑中动脉闭塞(MCAO)后缺血后血管生成、脑重塑和神经功能恢复的影响。在体外,从低氧(1%O2)而不是“常氧”(
来源于右侧细胞类型的间充质基质细胞(MSC)来源的小细胞外小泡(SEV)可促进中风的康复。在这一过程中,微血管重塑起着核心作用。因此,作者研究了MSCsEVs对体外培养的人脑微血管内皮细胞(hCMEC/D3)增殖、迁移和管状形成的影响,以及对小鼠大脑中动脉闭塞(MCAO)后缺血后血管生成、脑重塑和神经功能恢复的影响。在体外,从低氧(1%O2)而不是“常氧”(21%O2)的MSCs获得的SEV呈剂量依赖性地促进内皮细胞的增殖、迁移和管状形成,并增加缺血后内皮细胞的存活。来自低氧MSCs的SEV调控hCMEC/D3细胞中一组不同的miRNAs,其中3个上调(miR-126-3p,miR-140-5p,let-7c-5p),3个下调(miR-186-5p,miR-370-3p,miR-409-3p)。LC/MS-MS显示52种蛋白质在SEV中与低氧和正常氧的MSCs不同地丰富。缺氧MSC-SEV富含19个蛋白质(其中涉及细胞外基质-受体相互作用、斑点粘附、白细胞跨内皮细胞迁移、蛋白质消化和吸收的蛋白质),33个蛋白质减少(包括与代谢途径、细胞外基质-受体相互作用、斑点粘附和肌动蛋白细胞骨架相关的蛋白质)。MCAO后,来自低氧MSCs的SEV增加了先前缺血组织中的微血管长度和分支点密度,通过3D光片显微镜进行了长达56天的评估,减少了延迟的神经元退化和脑萎缩,并促进了神经恢复。SEV诱导的体内血管生成依赖于中性粒细胞的存在。在中性粒细胞耗竭的小鼠中,MSC-SEV不影响微血管重构。低氧骨髓间充质干细胞来源的SEV具有明显的血管生成特性。低氧预适应可增强MSC-SEV的恢复作用。
图片来源:https://doi.org/10.1007/s00395-021-00881-9
小的胞外小泡(Sev),如外泌体(50-150
nm),在细胞间的通讯中起着重要的作用。作为对伤害的反应,SEV可以促进恢复过程。由间充质基质细胞(MSC)上清液制备的SEV可促进大鼠和小鼠局灶性脑缺血后的神经恢复和脑重塑。sev具有重要的特点,使其具有治疗的吸引力。与细胞疗法不同,SEV不能自我复制,它们缺乏内源性肿瘤形成潜能。SEV几乎不能感知环境条件,因此可以比细胞更可靠地预测它们的生物活性。由于SEV产品体积小,可以通过过滤进行灭菌。因此,它们的处理要比细胞的处理容易得多。由于这些有希望的特征,SEV正迅速接近在人类患者身上的临床试验。
在一项小鼠的面对面研究中,作者先前已经证明,在常规条件下,即‘常氧’条件下(21%O2),从mscs培养上清液中获得的sev制剂与其亲代mscs在大脑中动脉闭塞(Mcao)后24小时静脉注射时,同样有效地减少了运动协调障碍,并提高了神经元的长期存活率。SEV诱导的神经保护伴随着持续的神经发生。在缺血脑中,神经发生和血管生成紧密联系在一起,这两个过程都与成功的脑重塑密切相关。由于脑微血管系统(即内皮细胞)暴露于静脉注射的SEV作为第一线靶点,血管生成的诱导可能有助于MSC-SEV保护缺血脑组织的能力。事实上,先前在小鼠注射MSC-SEV后的缺血脑中发现了内皮细胞增殖的证据。
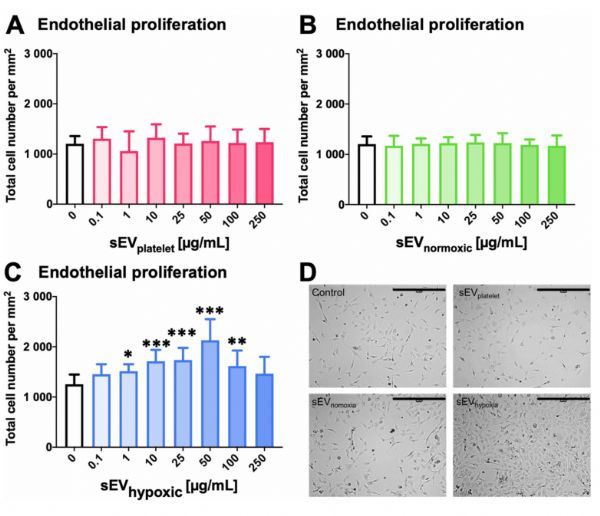
从低氧条件下培养的骨髓间充质干细胞(MSCs)获得的小细胞外小泡(SEV)可促进脑微血管内皮细胞增殖
图片来源:https://doi.org/10.1007/s00395-021-00881-9
MSC-SEV对微血管的作用强烈依赖于组织和病理生理状态。虽然msc-sev制剂可能促进或抑制肿瘤组织中的血管生成,取决于确切的msc来源和肿瘤微环境,但据报道,msc-sev通过缺氧诱导因子-1α(hif-1α)依赖的方式促进培养的人脐静脉内皮细胞(Huvecs)的增殖和管状形成。目前还没有系统研究MSC-SEV对脑微血管生成的影响。为了评价MSC-SEV对脑血管生成的影响,作者将人微血管内皮细胞(hCMEC/D3)暴露于两个随机选择的健康人供体MSCs的SEV制剂中,这两种SEV分别在常规的‘常氧’条件(21%O2)和低氧条件(1%O2)下培养,或者从含有血小板裂解物的MSC培养液中获得的SEV。在另外的研究中,接受MCAO的小鼠同样接受了来自“常氧”间充质干细胞、低氧间充质干细胞或细胞培养液的SEV制剂。在一些亚群中,以前被证明介导MSC-SEV急性神经保护作用的中性粒细胞(PMN)被耗尽。作者报道了从低氧而不是“常氧”的MSCs或培养液中获得的SEV可以诱导血管生成,如体外血管内皮细胞增殖、跨孔迁移或管状形成实验和体内微血管网络特征分析所表明的那样。有趣的是,来自低氧MSCs的SEV调控了hCMEC/D3细胞中迄今为止尚未识别的一组独特的miRNAs,这些miRNAs与血管生成有关。液相色谱/串联质谱(LC/MS-MS)揭示了低氧骨髓间充质干细胞(MSCs)SEV中以前未被发现的调节其血管生成特性的蛋白质。在体内,缺氧MSCsEVs的促血管生成作用被PMN耗竭所消除,表明PMN支持MSC-SEV在急性卒中后阶段的恢复作用。(生物谷 Bioon.com)
参考资料
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。