Nat Biotechnol | 北京大学伊成器等团队合作开发同时对5mC和5hmC进行单细胞分析的新方法
来源:生物探索 2024-02-14 11:16
该研究提出SIMPLE-seq(通过测序同时分析表观遗传胞嘧啶修饰),用于在单细胞和单碱基分辨率下联合分析5mC和5hmC。
北京大学伊成器及康奈尔大学朱晨旭共同通讯在Nature Biotechnology在线发表题为“Simultaneous single-cell analysis of 5mC and 5hmC with SIMPLE-seq”的研究论文,该研究提出了SIMPLE-seq,一种可扩展的基础分辨率方法,用于从数千个单细胞中联合分析5mC和5hmC。
基于5mC和5hmC位点的“C-to-T”突变信号的正交标记和记录,SIMPLE-seq可以在单个细胞中检测到来自相同分子的这两种修饰,并能够对异质生物样品进行无偏倚的DNA甲基化动力学分析。研究人员将该方法应用于小鼠胚胎干细胞、人外周血单核细胞和小鼠脑,获得了单细胞和单分子分辨率的联合表观基因组图谱。对这两种胞嘧啶修饰的综合分析揭示了不同细胞类型和细胞状态下与不同调控程序相关的不同表观遗传模式。

基因组的动态化学修饰,包括组蛋白尾部和DNA碱基,通过促进或抑制转录因子与它们的结合来调节基因表达。DNA 5-甲基胞嘧啶(5mC)是一种主要的表观遗传修饰,在DNA甲基转移酶和复制依赖或复制独立的去甲基化过程的驱动下,以细胞类型特异性的方式沉积或消除。复制无关的活性DNA去甲基化由TET家族蛋白介导,依次产生5-羟甲基胞嘧啶(5hmC)、5-甲酰基胞嘧啶(5fC)和5-羧基胞嘧啶(5caC),后两种形式的碱基切除修复以重新安装未修饰的胞嘧啶。5mC和5hmC都被证明在哺乳动物中调节多种生物过程,包括干细胞多能性、发育、衰老和肿瘤发生。
各种分子检测方法被开发出来,用于识别许多细胞类型和物种中调控元件的位置和状态。最近在单细胞基因组学中发展起来的方法通过获取基因表达、染色质高阶组织、染色质可及性、组蛋白修饰和DNA碱基修饰,在复杂生物系统的单细胞分辨率下一次或一起进行一种模式,彻底改变了基因调控网络的研究。特别是,开创性的单细胞甲基组分析揭示了5mC在不同细胞环境中的异质性和细胞类型特异性模式。
然而,亚硫酸盐处理依赖的方法不能从5mC中分离出5hmC,从混合输出中模糊了它们各自作用的功能解释。利用糖基化5hmC (5ghmC)依赖的限制性内切酶AbaSI,最近开发了在单细胞中定位5hmC的方法。开始深入了解5hmC的分布模式和生物学功能,并暗示其与其他表观遗传层,特别是5mC的关系的潜在意义。然而,一次测量这两种修饰只能捕获不同细胞群体的平均结果,而潜在的异质性关系,如在动态细胞系统中5mC和5hmC的产生所贡献的DNA甲基化平衡,可能会丢失。
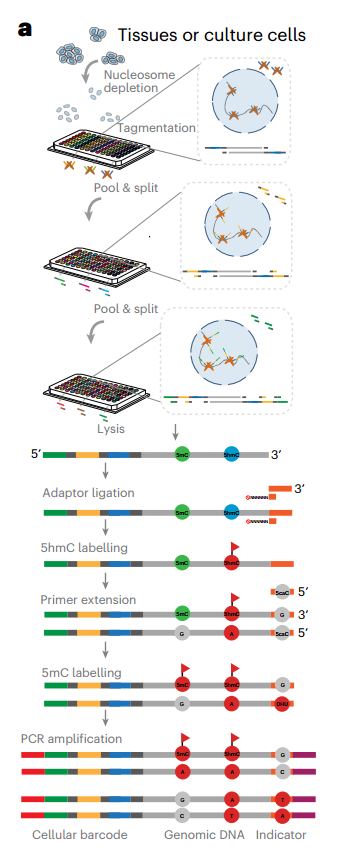
SIMPLE-seq原理图(Credit: Nature Biotechnology)
5mC和5hmC单细胞联合谱的主要挑战是从同一DNA分子中正交记录两种模式。为了解决这个问题,DNA模板应该被最小程度地破坏;因此,最近开发的无亚硫酸盐化学标记方法-例如,TET辅助吡啶硼烷测序(TAPS)和化学辅助5hmC测序的C-to-T转化(hmC-CATCH) -对5mC或5hmC温和且特异性的方法提供了潜在的机会。然而,目前的两种方法不允许正交记录两种修饰,因此不能直接相互兼容:阻断TAPS43中的5hmC模式,这保证了5mC检测的特异性,将使5hmC无法进一步标记和检测。
该研究提出SIMPLE-seq(通过测序同时分析表观遗传胞嘧啶修饰),用于在单细胞和单碱基分辨率下联合分析5mC和5hmC。SIMPLE-seq基于无亚硫酸盐化学标记反应的组合,顺序引入5mC和5hmC的“C-to-T”突变信号,并检测单个细胞中来自同一DNA分子的修饰的位置和类型。将SIMPLE-seq应用于小鼠胚胎干细胞(mESCs)、人外周血单个核细胞(PBMCs)和小鼠脑样本。在单细胞和单分子水平上对5mC和5hmC联合图谱进行综合分析,揭示了不同细胞状态和调控元件的不同表观遗传程序。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


