2022年HIV研究进展第1期
来源:本站原创 2022-03-01 20:57
人类免疫缺陷病毒(human immunodeficiency virus, HIV),即艾滋病(AIDS,获得性免疫缺陷综合征)病毒,是造成人类免疫系统缺陷的一种病毒。1983年,HIV在美国首次发现。它是一种感染人类免疫系统细胞的慢病毒(lentivirus),属逆转录病毒的一种。HIV通过破坏人体的T淋巴细
2022年3月1日讯/生物谷BIOON/---人类免疫缺陷病毒(human immunodeficiency virus, HIV),即艾滋病(AIDS,获得性免疫缺陷综合征)病毒,是造成人类免疫系统缺陷的一种病毒。1983年,HIV在美国首次发现。它是一种感染人类免疫系统细胞的慢病毒(lentivirus),属逆转录病毒的一种。HIV通过破坏人体的T淋巴细胞,进而阻断细胞免疫和体液免疫过程,导致免疫系统瘫痪,从而致使各种疾病在人体内蔓延,最终导致艾滋病。由于HIV的变异极其迅速,难以生产特异性疫苗,至今无有效治疗方法,对人类健康造成极大威胁。
自上世纪八十年代以来,艾滋病的流行已经夺去超过3400万人的生命。据世界卫生组织(WHO)统计,据估计,2017年,全世界有3690万人感染上HIV,其中仅59%的HIV感染者接受抗逆转录病毒疗法(ART)治疗。目前为止HIV仍然是全球最大的公共卫生挑战之一,因此急需深入研究HIV的功能,以帮助研究人员开发出可以有效对抗这种疾病的新疗法。为阻止病毒大量复制对免疫系统造成损害,HIV感染者需要每天甚至终身服用ART。虽然服用ART已被证明能有效抑制艾滋病发作,但这类药物价格昂贵、耗时耗力且副作用严重。人们急需找到治愈HIV感染的方法。
生物谷小编梳理了一下近期生物谷报道的HIV研究方面的新闻,供大家阅读。
1.Science:震惊!在荷兰发现一种新的高毒性的HIV毒株---VB变体
doi:10.1126/science.abk1688
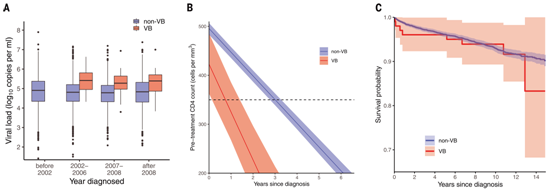
VB变体感染者的临床特点。图片来自Science, 2022, doi:10.1126/science.abk1688。
令人欣慰的是,在开始治疗后, VB变体感染者的免疫系统恢复和生存率与其他HIV变体患者相似。然而,这些作者强调,由于VB变体导致免疫系统强度更快速的下降,这使得感染者尽早被诊断并尽快开始治疗变得至关重要。
2.Science子刊:揭示癌症免疫治疗药物派姆单抗可逆转HIV潜伏
doi:10.1126/scitranslmed.abl3836
在一项新的研究中,一个国际研究团队发现癌症免疫治疗药物---派姆单抗(pembrolizumab)---能够逆转HIV潜伏,即这种病毒在接受抗逆转录病毒疗法的HIV感染者的细胞内“潜伏”的能力,这是治愈HIV的主要障碍。相关研究结果发表在2022年1月26日的Science Translational Medicine期刊上,论文标题为“Pembrolizumab induces HIV latency reversal in people living with HIV and cancer on antiretroviral therapy”。
派姆单抗可以逆转免疫系统的“衰竭”。具体来说,当杀伤性T细胞精疲力尽时,它们在它们的表面会表达一些蛋白,其中之一是PD1。抗PD-1抗体通过阻断这种衰竭标志物发挥作用,使杀伤性T细胞恢复功能并杀死癌症。这种药物已经彻底改变了包括黑色素瘤在内的几种癌症的治疗。
3.PNAS:揭示HIV利用宿主细胞自身的“紧急”反应进行复制
doi:10.1073/pnas.2105153118
在一项新的研究中,来自美国密苏里大学和明尼苏达大学的研究人员发现了HIV如何逃避身体的最佳防御系统之一。他们的研究结果可能为未来阻止HIV在体内传播的治疗方法带来希望。相关研究结果发表在2022年1月4日的PNAS期刊上,论文标题为“HIV-1 hypermethylated guanosine cap licenses specialized translation unaffected by mTOR”。

HIV-1 m7-G帽的高甲基化显著促进了传染性病毒的产生。图片来自PNAS, 2022, doi:10.1073/pnas.2105153118。
论文共同通讯作者、密苏里大学生物化学副教授Xiao Heng说,“当宿主细胞识别出HIV时,它将停止分裂,只是维持生存。作为回应,HIV从宿主那里学习,并利用细胞遭受应激时的反应方式。”
4.PLoS Pathog:番茄浓缩物有望降低与HIV感染相关的慢性肠道炎症
doi:10.1371/journal.ppat.1010160
在一项新的研究中,来自美国加州大学洛杉矶分校等研究机构的研究人员在小鼠中发现,在饮食中添加某种类型的番茄浓缩物可以减少与HIV感染有关的肠道炎症。如果不加以治疗,肠道炎症会加速动脉疾病,这反过来又会导致心脏病发作和中风。这些发现为肠道的改变如何影响慢性HIV感染者的致病性炎症提供了线索,并且表明靶向发炎的肠壁可能是预防全身性炎症的一种新方法,即使抗病毒治疗有效地控制了感染者体内的HIV,这种炎症仍然存在。相关研究结果于2022年1月7日发表在PLoS Pathogens期刊上,论文标题为“ApoA-I mimetics reduce systemic and gut inflammation in chronic treated HIV”。
论文通讯作者、加州大学洛杉矶分校医学院传染病科副教授Theodoros Kelesidis博士说,“炎症是保护身体不受感染和毒素入侵的一个重要过程。但是在那些因感染HIV而成功接受治疗使得体内的病毒载量不再能被检测到的感染者中,肠道细胞中持续的低度炎症会导致心脏病发作或中风的风险增加。”
5.Science子刊:精英控制者对HIV的清除性治愈可能隐藏着终结艾滋病的秘密
doi:10.1126/scitranslmed.abl4097
一些经诊断感染HIV病毒的患者能够在没有接受抗逆转录病毒药物甚至干细胞移植的情况下根除这种病毒,拥有天然抑制这种病毒的能力,实现了医学上可验证的治愈。科学家们称这一小群人为精英控制者(elite controller),这一称呼反映了他们拥有控制HIV的独特能力。最近几个月,这类患者中有两个人在科学文献中获得了声誉,每个人都有一个代号:一个称为旧金山患者(San Francisco Patient),另一个称为埃斯佩兰萨患者(Esperanza Patient)。这两人都是因从体内根除HIV而受到关注的女性。
除了这两个著名的例子之外,来自美国拉根研究所的研究人员在一项新的研究中将注意力集中在一个更大的精英控制群体(共58人)上,这些人凭借其独特的生物能力也能够控制住这种病毒。这些精英控制者与42名接受抗逆转录病毒药物(ART)治疗的HIV患者进行了比较,这42名患者在不接受ART治疗的情形下不能控制这种病毒,可作为全球绝大部分HIV感染者的代表。相关研究结果发表在2021年12月15日的Science Translational Medicine期刊上,论文标题为“Signatures of immune selection in intact and defective proviruses distinguish HIV-1 elite controllers”。
这些作者发现了一个表明精英控制者具有根除这种病毒的不寻常能力的新线索。一个原因是强大的免疫反应,但另一个原因是病毒基因序列潜伏在人类基因组中的位置。这些序列往往嵌入到较为偏远的染色体中,在那里它们不太可能复制,但更有可能被免疫力量发现。
6.NEJM:临床试验表明易于服用的度鲁特韦能更好地抑制儿童体内的HIV病毒
doi:10.1056/NEJMoa2108793
根据来自英国伦敦大学学院(UCL)的研究人员领导的一项全球临床试验,一种一天一次的基于度鲁特韦(dolutegravir)的抗逆转录病毒(ART)药物,成本低且易于儿童服用,在抑制HIV方面也比标准疗法(即非基于度鲁特韦的ART药物)更有效。他们发现与标准疗法相比,这种已广泛在成年患者中使用的基于度鲁特韦的治疗方案将3至18岁年轻感染者的治疗失败几率降低了约40%。相关研究结果发表在2021年12月30日的NEJM期刊上,论文标题为“Dolutegravir as First- or Second-Line Treatment for HIV-1 Infection in Children”。

图片来自NEJM, 2021, doi:10.1056/NEJMoa2108793。
7.Nat Methods:科学家开发出一种能对休眠状态下CD4+ T细胞进行遗传学特性分析的新技术
doi:10.1038/s41592-021-01328-8
理解HIV与休眠CD4+ T细胞之间的相互作用对于寻找新型治疗性手段至关重要,近日,一篇发表在国际杂志Nature Methods上题为“Rapid, efficient and activation-neutral gene editing of polyclonal primary human resting CD4+ T cells allows complex functional analyses”的研究报告中,来自德国慕尼黑大学等机构的科学家们通过研究开发了一种新方法,其或能首次实现在生理学条件下以有效且并不复杂的方式对这些特定的免疫细胞(CD4+ T细胞)进行遗传修饰,这或许能帮助研究人员深入理解这些细胞的生物学特性。
休眠的CD4+ T细胞几乎不适合进行遗传学修饰,因为现有的方法通常是以正在分裂的细胞为前提的,而根据定义,休眠的细胞是不会发生分裂的;因此,作为开发新方法的第一步,研究人员优化了培养条件,他们从健康捐赠者的血液中提取到了休眠的CD4+ T细胞后并在实验室中保持其活力长达6周时间,而不像此前只能保持3-4天,这种具有决定性的进展得益于核转染技术的进展,这种特殊方法能将试剂引入到细胞核中;利用这一技术,研究人员就能将基因剪刀CRISPR-Cas引入到休眠的CD4+ T细胞中,从而就能促进其对宿主细胞中的基因组进行靶向性的修饰,比如,以基因敲除的方式来消除基因。
这种组合非常有效,研究人员能够接触到大约98%的细胞并对其进行遗传学修饰,此外,在不激活CD4+ T细胞的情况下也能实现这一点;让研究人员特别激动的是,他们能利用单一核转染来实现同时高效消除高达6个基因,此前并没有研究人员能在原生细胞中做到这一点,而且研究人员还是从一个完整的器官中分离出来的细胞中做到的。因此,未来他们或许就能消除单个基因以及整个信号通路,并分析其功能;通过敲除相应的基因,研究人员就能设法阐明四个此前有争议的细胞因子是否在HIV感染时扮演着关键作用。
在此基础上,研究人员又推动了第二轮“基因敲入”(knock-in)方法,即插入额外或稍加修饰的基因,比如绿色荧光蛋白(GFP),在这种蛋白的帮助下,研究人员就能在特定的状况下分析靶向基因活性的改变,或者研究人员所标记的特定蛋白。所有这些东西加在一起就能让研究人员有机会首次调查在机体生理学状况下HIV如何与休眠的CD4+ T细胞发生相互作用。此外,研究人员还能更好地调查在HIV感染之外,休眠的CD4+ T细胞作为免疫细胞所发挥的一般作用。
8.Cell:一种新型的脂肽分子或有望作为有效治疗HIV感染的新型疗法
doi:10.1016/j.cell.2021.11.032
近日,一篇发表在国际杂志Cell上题为“Efficient treatment and pre-exposure prophylaxis in rhesus macaques by an HIV fusion-inhibitory lipopeptide”的研究报告中,来自中国医学科学院等机构的科学家们通过研究发现,他们所开发的一种脂肪分子或能有效抵御猴子版本的HIV病毒,文章中,研究人员描述了他们如何开发这种分子以及如何在猕猴机体中进行测试的。
这项最新研究中,研究人员所开发的脂质分子或有望未来某一天帮助患者从药物疗法体系中解脱出来。为了制造这种脂质分子,研究人员将胆固醇与氨基酸结合起来制造了LP-98分子,其是一类基于脂肽的融合抑制剂,研究者推测LP-98分子或能帮助抵御HIV病毒,为此他们将LP-98分子注射到了多只感染SIV(猿类免疫缺陷病毒)猕猴体内,SIV与HIV非常相似。
在测试中研究者发现,在猕猴接触SIV之前给其注射一定量的分子就能预防感染的发生,此外还能预防猕猴发生混合感染(HIV合并SIV感染);而且研究者还发现,给予21只猕猴注射这种LP-98分子或能将其机体中的病毒载量降低到无法再被检测到的程度,而且即使当研究人员停止给猕猴注射LP-98分子后这种保护作用仍然能不同程度地存在,而且大约20%的猕猴能达到一种稳定状态,这或许就表明其已经摆脱了病毒的感染;40%的猕猴表现出了稳定的病毒反弹;而30%的猕猴则表现出了不稳定的病毒反弹;后期研究人员计划进一步研究来观察这一数量是否能得到改善,并揭示LP-98分子在人类患者机体中的治疗效果。
9.PNAS:揭示HIV选择性包装它的RNA基因组进行复制的机制
doi:10.1073/pnas.2114494118
在一项新的研究中,来自美国国家癌症研究所和俄亥俄州立大学的研究人员发现HIV RNA序列中的一个小差异如何能让病毒RNA被包装起来进行复制,从而为在未来开发HIV治疗方法提供潜在的新靶标。相关研究结果发表在2021年12月14日的PNAS期刊上,论文标题为“Selective packaging of HIV-1 RNA genome is guided by the stability of 5′ untranslated region polyA stem”。
这些作者研究了两种几乎相同的HIV-1 RNA:带有一个5' G的HIV RNA(1G RNA)和带有三个5' G的HIV RNA(3G RNA)。1G RNA在HIV的病毒颗粒中富集,而3G RNA基本上不存在。他们发现这种病毒利用RNA最末端的两个核苷酸差异来区分细胞RNA和病毒RNA。由于所形成的构象或结构,1G RNA被包装成HIV RNA基因组的效率比3G RNA更高。
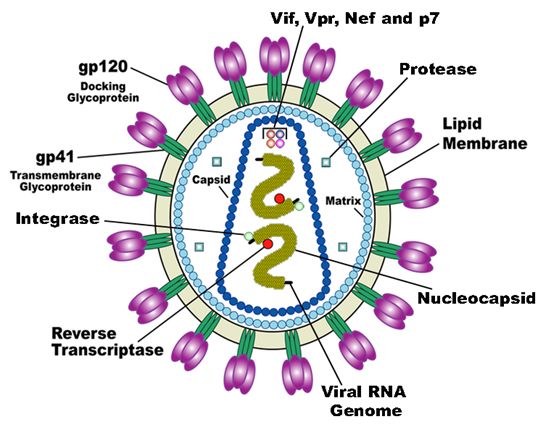
HIV病毒示意图,图片来自US National Institute of Health/Wikipedia。
10.Nat Med:临床前研究表明一种实验性mRNA HIV疫苗安全的,可将感染风险降低79%
doi:10.1038/s41591-021-01574-5
在一项新的研究中,来自美国国家过敏与传染病研究所(NIAID)的研究人员指出一种基于mRNA的实验性HIV疫苗--与两种高效的COVID-19 mRNA疫苗所用的平台技术相同--在小鼠和非人灵长类动物身上显示出了希望。他们的研究结果表明,这种新型疫苗是安全的,并能引发针对一种类似于HIV的病毒(即SHIV)的抗体和细胞免疫反应。与未接种这种疫苗的恒河猴相比,在接种初始疫苗(priming vaccine)以及此后多次接种加强疫苗的恒河猴每次接触猿-人类免疫缺陷病毒(simian-human immunodeficiency virus, SHIV)后的感染风险下降了79%。相关研究结果于2021年12月9日在线发表在Nature Medicine期刊上,论文标题为“A multiclade env–gag VLP mRNA vaccine elicits tier-2 HIV-1-neutralizing antibodies and reduces the risk of heterologous SHIV infection in macaques”。论文通讯作者为NIAID免疫调节实验室的Paolo Lusso博士。
这种实验性疫苗的工作原理与COVID-19 mRNA疫苗类似。不过,该疫苗并不携带SARS-COV-2冠状病毒刺突蛋白的mRNA指令,而是提供制造两种关键HIV蛋白---Env和Gag---的编码指令。接种这种疫苗的动物中的肌肉细胞将这两种蛋白组装起来,产生病毒样颗粒(virus-like particle, VLP),其表面上有许多Env的拷贝。虽然这些VLP因缺乏HIV的完整遗传密码而不能引起感染或疾病,但是它们在刺激适当的免疫反应方面与完整的传染性HIV相匹配。
这些作者报告说,在对小鼠的研究中,两次注射这种形成VLP的mRNA疫苗在所有动物中诱发了中和抗体。由mRNA指令在小鼠体内产生的Env蛋白与完整HIV病毒中的Env蛋白非常相似,这是对之前的实验性HIV疫苗的一种改进。Lusso博士说,“在每个VLP表面上展示多个Env拷贝的HIV包膜蛋白是我们平台的特殊功能之一,它密切模拟自然感染,并可能在激发所需的免疫反应方面发挥了作用。”
这些作者随后在恒河猴身上测试了这种实验性mRNA疫苗:Env-Gag VLP mRNA疫苗。这种疫苗方案的细节在不同的疫苗接种动物亚群中有所不同,但都涉及到用经过修改的疫苗来激发免疫系统,以优化抗体的产生:在初始疫苗接种后,在一年内进行多次加强疫苗接种。加强疫苗包含来自两种HIV亚型的Gag mRNA和Env mRNA,这两种HIV亚型与初始疫苗中使用的一种HIV亚型不同。他们使用多种病毒变体来优先激活靶向Env中更保守的“相同”区域---广泛中和抗体的结合靶标---而不是靶向每种病毒毒株中不同的更多可变区域的抗体产生。
11.eLife:重要成果!硫化氢气体或能抑制HIV感染!
doi:10.7554/eLife.68487
在根除HIV上科学家们所面临的一个基本挑战就是理解病毒如何建立潜伏期并维持稳定的细胞存储库,并在抗逆转录病毒(ART)疗法中断时促进反弹。近日,一篇发表在国际杂志eLife上题为“Hydrogen sulfide blocks HIV rebound by maintaining mitochondrial bioenergetics and redox homeostasis”的研究报告中,来自印度科学研究所等机构的科学家们通过研究识别出了硫化氢气体(hydrogen sulfide)在抑制人类HIV上所扮演的关键角色。研究者发现,增加硫化氢的水平或会直接影响并减少病毒在HIV感染的人类免疫细胞中的繁殖率,这一研究结果或为科学家们开发抵御HIV的全面抗逆转录病毒疗法提供了新的线索和思路。
如今,科学家们开始探索在HIV感染的细胞中硫化氢的存在对机体氧化性压力和线粒体功能异常的有益影响,此前研究中,研究者Singh开发了一种新型工具来测定HIV所感染的细胞中的氧化性压力;这篇研究报告中,研究人员表示,化学制剂N-乙酰半胱氨酸或能抑制在感染细胞中潜伏的HIV再度被激活。随后一篇来自德国研究人员的研究发现,N-乙酰半胱氨酸或许能通过释放硫化氢分子来部分发挥作用,而这正是研究人员开始研究其所扮演角色的时候;此前研究者Singh的实验室分析了在HIV感染期间通过利用一种抗氧化剂纳米酶类如何中和抗氧化压力的效应,由于硫化氢能向抗氧化分子一样发挥作用,因此研究人员就想研究观察是否此前关于氧化性压力和HIV的观点能转化为揭示硫化氢对HIV感染的影响效应。
研究人员分析了在HIV感染的细胞中自然产生的硫化氢的效应,并利用化学供体来补充硫化氢;他们观察到了硫化氢在抑制HIV再度激活以及复制上的直接效应,同时其还带来一些其它的有益效应,比如在细胞模型中维持线粒体的健康以及抵御氧化性压力的发生,本文研究结果表明,HIV潜伏期的维持和再激活与受感染细胞中硫化氢的水平或许密切相关。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


