STTT:四川大学何勤/李曼团队开发阿尔茨海默新疗法
来源:生物世界 2025-11-05 15:34
通过将同步双自噬激活与靶向仿生递送相结合,AR@ENV 有望成为治疗阿尔茨海默病的候选药物。
阿尔茨海默病(AD)是最常见的神经退行性疾病,其特征为两种病理标志:β-淀粉样蛋白(Aβ)在细胞外沉积,与多种蛋白质聚集形成蛋白斑块;以及细胞内过度磷酸化的 tau 蛋白积累,导致神经原纤维缠结。这些改变会损害神经元功能,促进有毒蛋白质聚集,破坏金属离子稳态,并引发炎症反应,所有这些都会促使阿尔茨海默病的发展。
目前获批用于治疗阿尔茨海默病(AD)的药物疗法,例如乙酰胆碱酯酶抑制剂和 NMDA 受体拮抗剂,仅能缓解症状,而不能改变疾病的发展进程。相比之下,抗 Aβ 单克隆抗体的出现,标志着向疾病修正策略的转变。这些单克隆抗体能减轻一些患者的 Aβ 斑块负担,并减缓认知能力下降;然而,它们存在显著的局限性:血脑屏障(BBB)渗透率低,需要高剂量全身给药;对新生成的 Aβ 无作用,对 tau 蛋白病理的影响也有限。同样,新兴的抗 tau 蛋白疗法,也面临着脱靶毒性以及临床疗效不佳等挑战。
2025 年 11 月 3 日,四川大学华西药学院何勤教授、李曼副教授等在 Signal Transduction and Targeted Therapy 期刊发表了题为:Microglia-derived nanovesicles synchronize macroautophagy and chaperone-mediated autophagy for Alzheimer’s disease therapy 的研究论文。
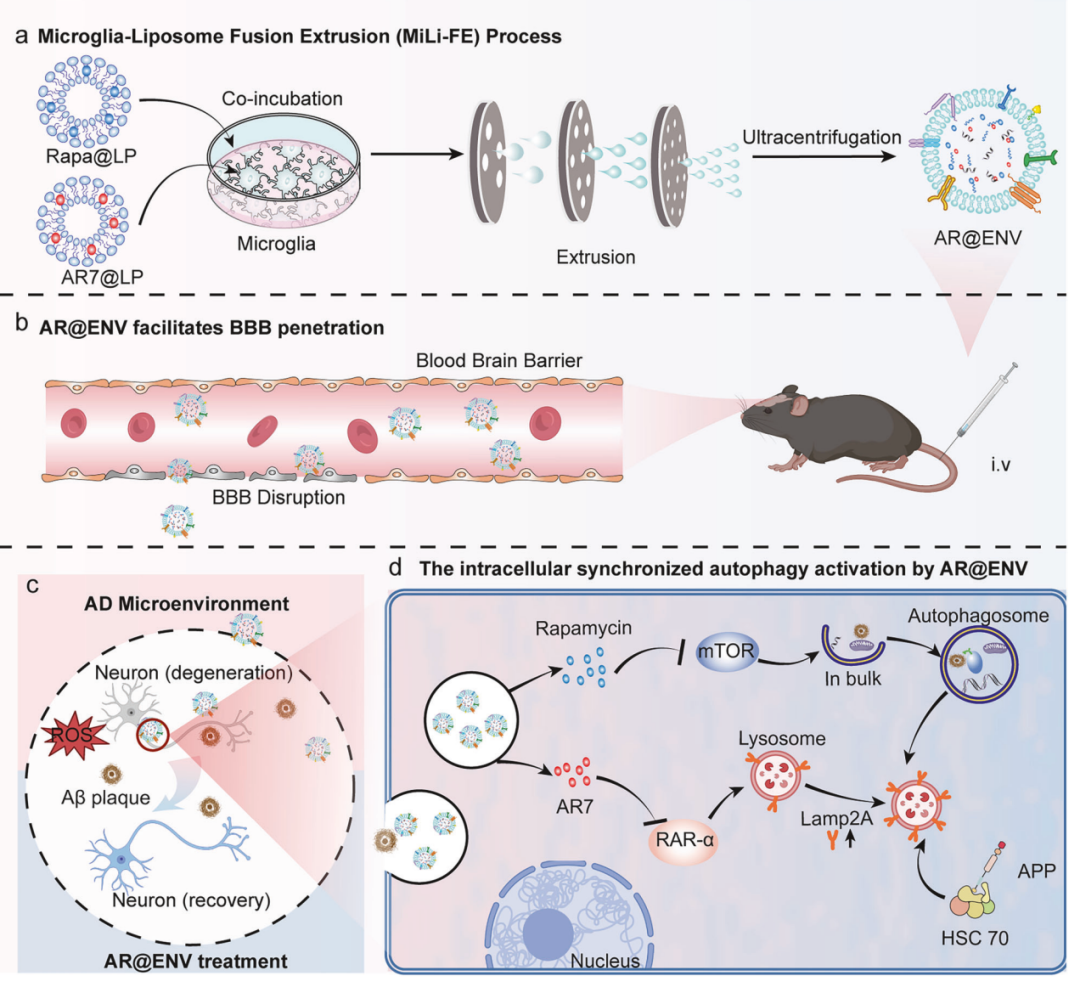
该研究开发了小胶质细胞脂质体融合挤出法(Microglia-Liposome Fusion Extrusion,简称为 MiLi-FE),用于制备小胶质细胞来源的纳米囊泡,可突破血脑屏障,共递送雷帕霉素和 AR7,同时激活阿尔茨海默病中失调的巨自噬和分子伴侣介导的自噬,以治疗阿尔茨海默病。

细胞自噬失调是阿尔茨海默病(AD)的一个显著特征,但其中巨自噬(macroautophagy)和分子伴侣介导的自噬(chaperone-mediated autophagy,CMA)受损的程度仍不清楚。
在这项最新研究中,研究团队证实,在阿尔茨海默病模型小鼠中,巨自噬和分子伴侣介导的自噬均受到破坏,且先于 β-淀粉样蛋白(Aβ)的积累,并推动疾病的发展。然而,治疗性自噬调节受到血脑屏障(BBB)的严重限制。
为克服这一难题,研究团队开发了小胶质细胞脂质体融合挤出法(Microglia-Liposome Fusion Extrusion,简称为 MiLi-FE),这是一种用于制备小胶质细胞来源的纳米囊泡(AR@ENV)的方法,可实现 AR7(一种 CMA 诱导剂)和雷帕霉素(一种巨自噬诱导剂)的共递送。
AR@ENV 利用其源自小胶质细胞膜的特性,能够有效地穿过血脑屏障,并靶向阿尔茨海默病患者大脑中的炎症部位,在那里被神经元内化。一旦进入细胞内,它们会同步激活两种自噬途径:AR7 会拮抗维甲酸受体 α(RARα)以增强分子伴侣介导的自噬,而雷帕霉素则会抑制 mTOR 以促进巨自噬。
这种协同激活,增强了 β-淀粉样蛋白(Aβ)和其他有毒蛋白聚集体的清除,恢复了蛋白质稳态,并提供了强大的神经保护作用。此外,该策略还改善了神经炎症,并在两种不同的阿尔茨海默病小鼠模型中显著挽救了认知缺陷。
通过将同步双自噬激活与靶向仿生递送相结合,AR@ENV 有望成为治疗阿尔茨海默病的候选药物。此外,MiLi-FE 平台为向中枢神经系统(CNS)递送多种治疗药物提供了一种灵活且可扩展的方法,从而将其潜在适用性扩展到一系列神经系统疾病。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


