研究建立基于人内胚层干细胞的规模化肝向分化系统
来源:分子细胞卓越中心 2021-01-06 12:57
近期,中国科学院分子细胞科学卓越创新中心研究员程新、北京大学生命科学学院教授徐成冉、分子细胞卓越中心研究员陈洛南和上海长征医院教授殷浩合作,在Cell Reports上,发表题为Large-scale Generation of Functional and Transplantable Hepatocytes and C
近期,中国科学院分子细胞科学卓越创新中心研究员程新、北京大学生命科学学院教授徐成冉、分子细胞卓越中心研究员陈洛南和上海长征医院教授殷浩合作,在Cell Reports上,发表题为Large-scale Generation of Functional and Transplantable Hepatocytes and Cholangiocytes from Human Endoderm Stem Cells的研究成果。
肝脏由肝实质细胞(hepatocytes)和胆管上皮细胞(cholangiocytes)等多种细胞构成,其损伤及功能紊乱会严重影响人类健康。肝脏移植是目前治疗终末期肝病最有效的手段之一,但其应用受制于供体匮乏。体外再造肝脏组织/器官是解决供体来源的有效途径,但也受制于肝脏细胞的来源限制。此外,肝脏细胞的来源短缺和肝组织体外模型的缺失制约了药物筛选及毒理研究。由于肝脏包含超过1011的肝实质细胞和约1010的胆管上皮细胞,上述应用对肝脏细胞的来源、数量、纯度、质量及安全性等方面提出了要求。因此,建立高效的肝脏细胞体外规模制备及质检体系是应对该挑战的较好选择,其也成为当今转化医学研究的热点和难点。
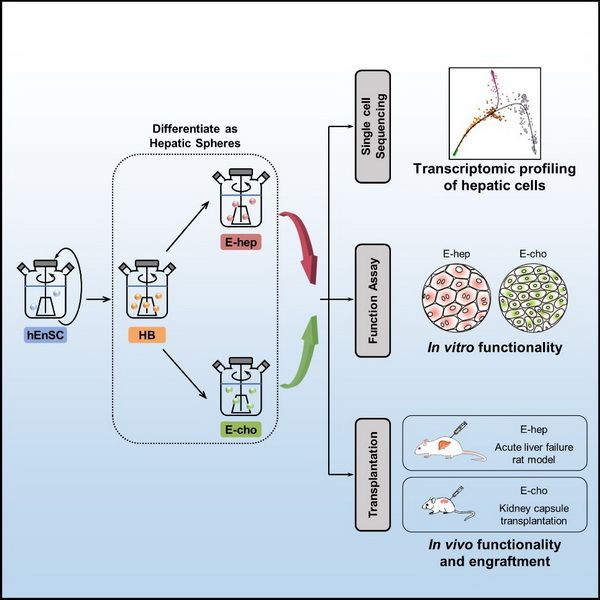
为了满足肝病治疗及体外药物筛选等应用对肝脏细胞在数量、质量及安全性等方面的要求,研究人员建立了高效的基于人内胚层干细胞系(hEnSCs)的体外规模化肝向分化体系,使规模制备高纯度的肝母细胞、肝实质细胞(E-heps)及胆管上皮细胞(E-chos)成为可能。研究人员利用单细胞转录组测序技术,深入解析了该体系各关键分化步骤的细胞群体,并与原代及其他来源的肝实质细胞进行了系统的对比。功能实验显示,E-heps和E-chos具有成体细胞的分泌、代谢及解毒功能;包囊化的E-heps经移植后可挽救急性肝衰动物;E-chos在小鼠肾包囊下可形成胆管网络。该研究为肝病治疗及疾病模拟提供了细胞规模制备及质检体系。
该研究建立的基于人内胚层干细胞的规模化肝向分化系统为体外药物筛选、肝病模拟、肝脏体外构建以及肝病细胞治疗等应用奠定了技术及理论基础。未来的研究方向将聚焦于体系的优化完善,包括寻找更优的起始种子细胞类型(如双潜能的肝干细胞系等)、进一步降低终末分化细胞的群体异质性、进一步提高终末分化细胞体内整合及再殖能力,进而探索利用体外制备的肝脏细胞构建血管化和胆管化的肝组织以及肝病细胞治疗的可行性。 (生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


