EHJ重磅:中国**冠心病多基因风险评分模型诞生
来源: 奇点糕 2022-05-12 21:07
由于个体的遗传背景与生俱来,并且终生稳定,可以在很早的时候就能进行风险评估。
心血管疾病受环境和遗传因素影响。近十年,基因组学研究已成功发现数百个冠心病以及相关表型的易感基因[1]。
在欧洲人群中,已有多个冠心病多基因风险评分(PRS)模型被开发出来[2-5]。既往研究表明PRS能提升传统临床风险评估的准确性[6]。然而,PRS模型在欧洲以外的人群中少有研究,其在亚洲人群的预测效果仍然有待评估。
近期,由国家心血管病中心/中国医学科学院阜外医院顾东风院士和鲁向锋教授领衔的研究团队,在《欧洲心脏杂志》(European Heart Journal)发表了中国人群的首个冠心病多基因风险评分模型,并基于前瞻性队列发现其能提升传统临床风险评估模型的再分层能力。
在4万人的随访中(平均随访时间13年),高遗传风险者(评分最高的20%)的冠心病发病风险是低遗传风险者(评分最低的20%)的近3倍(HR=2.91)[7]。
研究论文截图
心血管疾病被世界卫生组织评定为全球死亡的主要原因。仅2019年(新冠爆发前),就有约1800万人死于心血管疾病,占据全球死亡人数的32%[8]。其中,85%的心血管疾病死因是由于心脏病发作和中风。
在我国,由于人口老龄化,以及经济飞速发展衍生的亚健康生活方式、饮食和环境的改变等原因,冠心病的发病率在持续攀升[9]。在2017年,我国冠心病死亡人数比1990年增加了111.7万,增幅接近200%[10]。同期,全球冠心病相关死亡率下降30%,但我国年龄校正的冠心病死亡率增加20.6%。
早期预防和干预是控制冠心病发生发展的重要手段。当前,《中国心血管疾病风险评估与管理指南》(下称《指南》)推荐的风险评估模型(China-PAR)是基于传统临床指标,如年龄、饮食和生活习惯等[11]。遗传信息有着可靠和稳定的特性,而临床风险指标多变,遗传风险评分很有可能会提升临床风险评估能力,有着巨大的潜在应用价值。
构建基因风险评估模型首先需要找到可靠的遗传位点。研究团队整合中国、日本、新加坡和韩国等26万东亚人群的冠心病基因组数据,锁定了588个与冠心病相关的遗传变异位点。
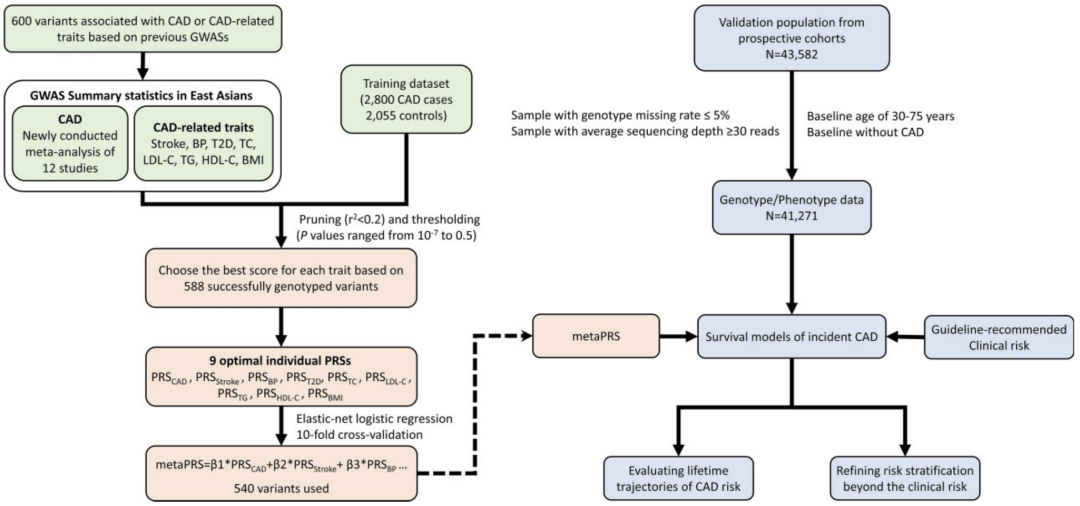
研究流程图
由于血压(BP)、胆固醇(HDL/LDL)、甘油三酯(TC)和身体质量指数(BMI)等与冠心病有一定的关联,在模型构建中,研究者也整合了这些表型与遗传变异的关联信息。
随后,基于2800位冠心病患者(年龄51.59±7.36)和2055位对照者(年龄54.77±7.53)组成的训练集,构建了中国人首个冠心病多基因风险评分模型,记为metaPRS。该评分模型包含540个跟冠心病或相关表型关联的遗传位点(P<5x10-8)。
为验证遗传风险评分的效果,研究团队在4万多人(年龄52.3±10.6)组成的前瞻性队列中全面评估该模型的效果(人群特征见图1),男性比例为42.5%。最长随访时间约20年,平均随访时间为13年。随访过程观测到1303次心血管发病事件。
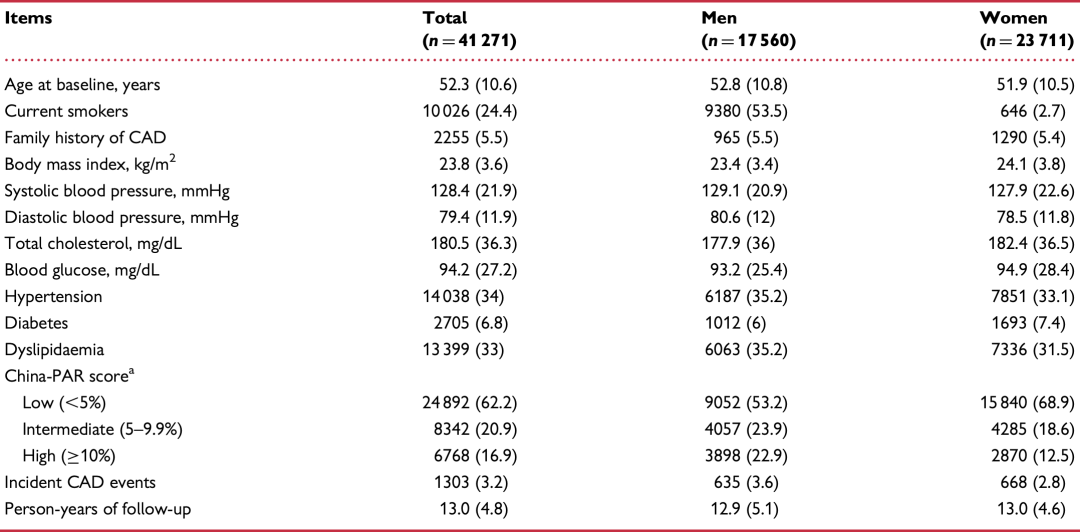
图1:4万人的前瞻性队列概况
在验证人群中,当遗传风险评分增加一个标准差(SD)时,冠心病的发病风险比为1.44,即发病风险增加44%。
在终生(累计到80岁)风险评估中,高遗传风险者(metaPRS评分最高的20%)发生冠心病的风险约为低遗传风险者(metaPRS评分最低的20%)的3倍,分别为15.9%和5.8%(图2)。对于低遗传风险者,如果没有家族史,冠心病终生发病风险为5.6%。对于高遗传风险者,若同时伴有家族史,冠心病终身发病风险可达到27.7%,是前者的5.66倍。
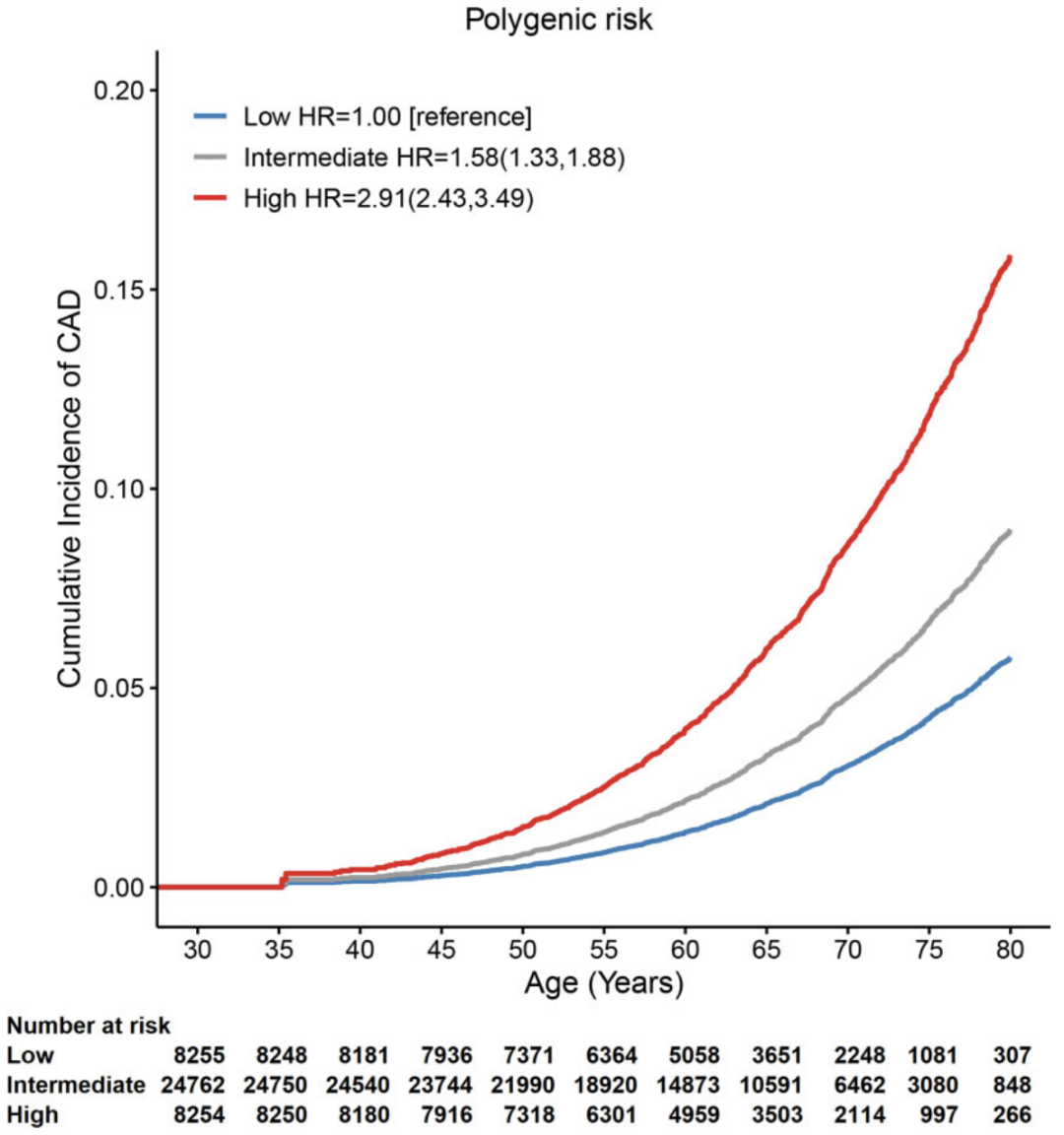
图2:验证人群中不同遗传风险等级个体的终生冠心病发病风险曲线。低分险组(Low)是遗传评分最低的20%,高风险组(High)是遗传评分最高的20%,中等风险组(Intermediate)是遗传评分取值为中间的20%-80%。
既然遗传风险评分与冠心病发病风险显著相关,那么它是否能改善现行《指南》中传统临床风险评估模型呢?
研究者将传统临床风险评估和遗传风险评分相结合,发现遗传风险评分能显著提升临床风险评估模型的能力。引入遗传风险评分后,评估模型的C-统计量(一种模型准确性指数,取值越高表示模型越好)提升了1%(P=7.72 x 10-7)。并且,重分类改善指标达到3.5%。
临床应用中,遗传风险评分是否能使人群风险分层更精准呢?
在高临床风险个体中,高遗传风险者的10年期冠心病发病风险是低遗传风险者的近两倍,分别为7.1%和3.3%(图3)。相应地,终生发病风险分别为24.1%和11.3%。
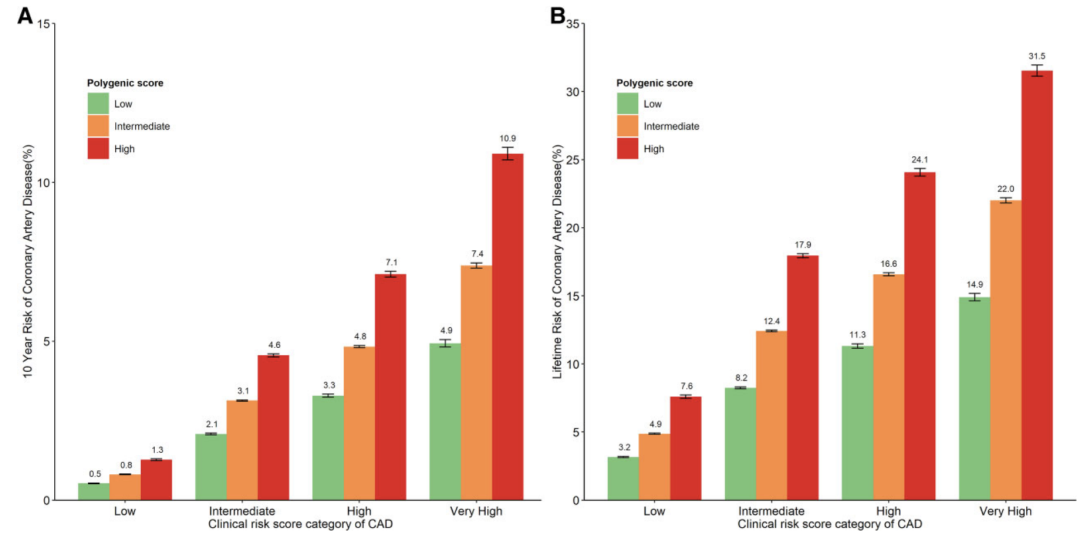
图3:不同风险等级个体的10年期和终生(截止年龄80岁)冠心病发病风险分布。个体按传统临床风险和多基因遗传风险划分到不同分组。临床低风险、中风险、高风险和极高风险组的10年期发病率分别为<2.5%, 2.5-4.4%,4.5%-5.9%和6%;相对应地,终生发病率分别为<5,5-9.9,10-14.9和15%。遗传低分险组(Low)评分最低的20%,遗传高风险组(High)是评分最高的20%,遗传中风险组(Intermediate)是评分取值为中间的20%-80%。
更为突出的是,在临床风险评分为中风险的个体中,高遗传风险者的10年期冠心病发病风险为4.6%(对应于10%的动脉粥样硬化性心血管疾病风险)。这个风险等级与那些高临床风险伴中等遗传风险的个体相当(4.6% vs. 4.8%)。
根据指南[12],动脉粥样硬化性心血管疾病风险超过10%的个体需要进行药物治疗。因此对那些中等临床风险的个体,通常由于干预效果的不确定性,很可能错过及时的干预。而遗传风险评分能精准识别出高风险个体,为疾病预防提供重要依据。研究还发现相同临床风险但不同遗传风险个体间的发病风险差异与性别、年龄无关。
由于个体的遗传背景与生俱来,并且终生稳定,可以在很早的时候就能进行风险评估。与传统临床风险因子不同,遗传风险不受年龄影响。因此,遗传风险评分能弥补传统临床风险评估模型的不足,两者的结合对人群风险划分和疾病防控具有潜在的应用价值。
综合以上发现,该研究提出了根据个体的临床和遗传风险进行心血管健康管理的路径和方案(图4)。《欧洲心脏杂志》同期对该研究在预防和临床实践中的应用价值进行了点评[13]:对于年轻人,在临床风险表现出来之前,多基因遗传风险评分是最有效的工具去识别冠心病高风险者。
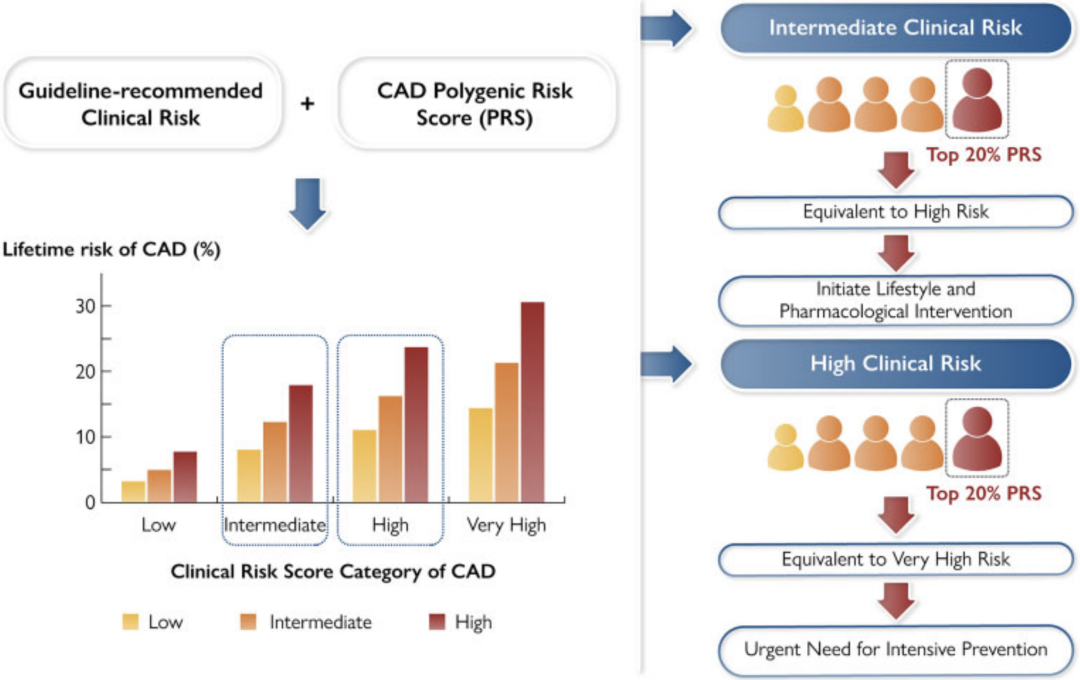
图4:研究论文的图形摘要。多基因遗传风险评分能改善《指南》推荐的传统临床风险模型对人群的分层,特别是对那些中等临床风险并且遗传高风险的人群。
如果能依据该研究发现开发简便的遗传风险因子检测芯片,实现科技成果转化,推广到冠心病的早期发病风险预测、高危人群分层和管理等,将有助于提升我国心血管疾病的防控水平,降低冠心病负担,造福社会。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


