Nature子刊:破坏相分离,增强抗肿瘤免疫
来源:生物世界 2023-03-15 17:21
该研究揭示了在IFNγ刺激下,肿瘤细胞中KAT8-IRF1通过形成具有促进转录功能的凝聚体,增强PD-L1表达的分子机制;发现了凝聚体形成可增强KAT8对IRF1乙酰化催化速率;开发了抑制凝聚体形成的
肿瘤细胞表达的PD-L1是抗肿瘤免疫监视的主要抑制因子之一,肿瘤微环境中伽马干扰素IFNγ可强烈诱导PD-L1表达。PD-L1通过与PD-1结合,抑制T细胞增殖并促进其耗竭;在肿瘤细胞内部,PD-L1发挥多种功能促进肿瘤免疫逃逸,如增加肿瘤细胞抵抗干扰素的细胞毒性、增强DNA损伤修复和促进免疫抑制基因的表达。临床上,靶向肿瘤PD-L1的免疫治疗在部分肿瘤取得了良好的治疗效果,但仍面临机制不明、响应率低等诸多问题。因此,系统性深入研究PD-L1表达调控机制,有助于开发新的靶向药物,对于肿瘤治疗有重要意义。
生物大分子可通过多价弱相互作用介导的液-液相分离(LLPS,简称相分离)形成生物分子凝聚体(biomolecular condensates),该理论是近年生命科学领域的概念性突破。相分离与神经退行性疾病、肿瘤、病毒感染等重大疾病密切相关,靶向相分离过程的疾病治疗是目前生物医学前沿。但目前相分离过程的靶点鉴定、发生机制、与疾病发生发展的关系等研究仍处于起步阶段,亟待深入探索。
近日,中山大学肿瘤防治中心康铁邦/武远众团队在 Nature 子刊 Nature Cancer 上发表了题为:Disrupting the phase separation of KAT8–IRF1 diminishes PD-L1 expression and promotes antitumor immunity 的研究成果。
该研究揭示了KAT8-IRF1凝聚体促进肿瘤细胞PD-L1表达,开发特异性多肽阻断该凝聚体形成,可增强抗肿瘤免疫。

为深入揭示IFNγ诱导PD-L1表达的调控机制,研究团队利用全基因组CRISPR-Cas9文库进行筛选,发现乙酰转移酶KAT8可调控PD-L1的表达,这一机制在多种肿瘤细胞系中得到验证。KAT8是细胞内组蛋白H4K16ac主要乙酰转移酶,除此之外,KAT8也被报道乙酰化非组蛋白底物,调控细胞自噬、压力应激等过程。接下来,研究团队试图探明KAT8通过何种机制调控PD-L1转录。利用TurboID邻近标记联合质谱分析,研究团队鉴定到转录因子IRF1与KAT8存在相互作用,IRF1是IFNγ通路下游分子之一,已被报道可转录上调PD-L1。
接下来,研究团队探究了KAT8与IRF1如何调控PD-L1。在检测二者定位时,发现共表达mEGFP-KAT8与IRF1-mCherry在细胞核内可形成液滴状凝聚体,该凝聚体具有融合及荧光漂白恢复能力,体外纯化的蛋白也具有相同性质,提示KAT8-IRF1通过液-液相分离形成蛋白凝聚体。进一步,研究团队测定了IFNγ刺激下细胞核内源KAT8与IRF1的蛋白浓度,并在体外实验中观察到生理浓度下的凝聚体形成,同时,研究团队利用SIM超分辨成像,观察到细胞核内存在KAT8-IRF1共定位斑点,提示KAT8-IRF1在生理浓度水平可形成蛋白凝聚体。
然后,研究团队解析了KAT8-IRF1凝聚体产生的结构基础。首先,IRF1 N端DNA结合结构域与KAT8发生特异性互作,然后发生IRF1 C端的内在无序结构域(Intrinsically disordered region, IDR)与KAT8 N端IDR互作,共同介导凝聚体形成。KAT8-IRF1凝聚体可募集RNAP II-S5P、CDK7、CDK9、BRD4等转录机器组分,并增强转录激活能力。利用dCas9-SunTag-sgARRAY进行基因组定位,研究团队观察到内源KAT8-IRF1凝聚体可定位于PD-L1启动子。
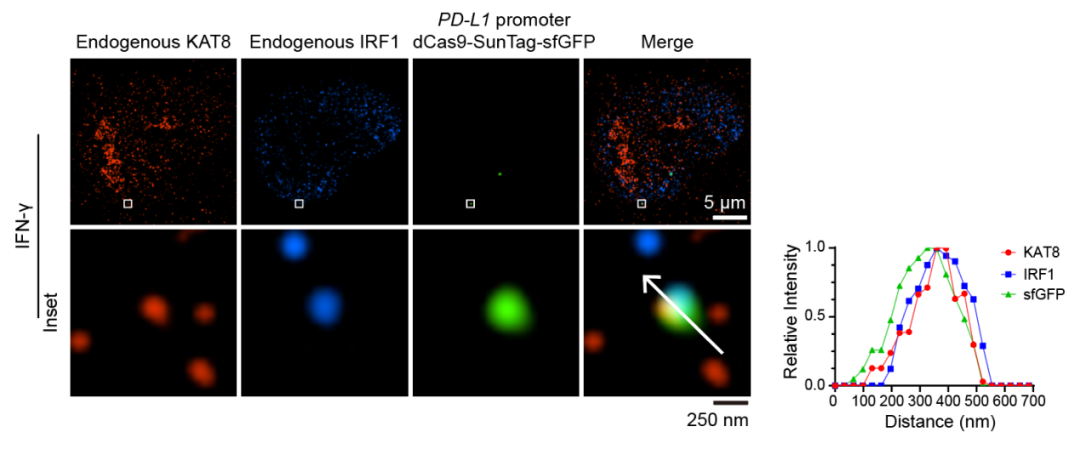
图1. 内源KAT8与IRF1在PD-L1启动子区域形成凝聚体
KAT8已报道可催化非组蛋白底物,研究团队发现KAT8可乙酰化IRF1 K78位点,凝聚体形成可增强催化速率约40倍,IRF1 K78ac可增强与PD-L1启动子结合能力。
根据KAT8-IRF1凝聚体形成的结构基础,研究团队基于IRF1 N端与KAT8的特异性相互作用进行深入分析,发现IRF1的21-42位氨基酸是介导特异性互作的主要区域。进而研究人员合成了该区域的竞争性多肽,并观察到该多肽可特异性阻断二者相互作用并破坏凝聚体形成,抑制IRF1乙酰化及PD-L1转录,增强T细胞的抗肿瘤免疫杀伤。

图2:KAT8-IRF1 相分离促进肿瘤细胞 PD-L1表达,阻断该相分离抑制PD-L1, 促进抗肿瘤免疫
综上,该研究揭示了在IFNγ刺激下,肿瘤细胞中KAT8-IRF1通过形成具有促进转录功能的凝聚体,增强PD-L1表达的分子机制;发现了凝聚体形成可增强KAT8对IRF1乙酰化催化速率;开发了抑制凝聚体形成的阻断多肽,并证明其抗肿瘤活性。该研究提示肿瘤相关生物大分子凝聚体可能是一类肿瘤治疗新靶点,值得深入探索。
中山大学肿瘤防治中心武远众副研究员、周立文博士为该论文共同第一作者;中山大学肿瘤防治中心康铁邦教授为通讯作者。
康铁邦教授以通讯作者在 Nat Cancer、Nat Cell Biol、Cell Res、J Clin Invest、Nat Commun 等国际主流杂志上发表论著50多篇。武远众副研究员为课题组co-PI,以通讯/第一作者发表 Nat Cancer、Nucleic Acids Res、Cell Res、Cell Discov、Nat Commun、JBC、Cell Mol Life Sci、STTT 等杂志。该课题组长期招聘博士后,欢迎有志者加盟。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


