Nat Biomed Eng | 刘玉英/梁俊波/熊春阳发现PIEZO1机械调节T淋巴细胞的抗肿瘤细胞毒性
来源:生物探索 2024-03-25 10:41
该研究强调了机械转导在调节免疫反应中的重要性,并提出了通过靶向PIEZO1和相关的机械调节途径进行癌症免疫治疗的治疗机会。
中国医学科学院/北京协和医学院刘玉英、梁俊波及北京大学熊春阳共同通讯在Nature Biomedical Engineering 在线发表题为“PIEZO1 mechanically regulates the antitumour cytotoxicity of T lymphocytes”的研究论文,该研究表明阻断T细胞中的机械传感器PIEZO1增强了它们的牵引力并增强了它们对肿瘤细胞的细胞毒性。该研究表明阻断T细胞中的机械传感器PIEZO1增强了它们的牵引力并增强了它们对肿瘤细胞的细胞毒性。
通过利用从小鼠肿瘤模型和癌症患者中收集的细胞毒性T细胞,研究发现PIEZO1上调转录因子GRHL3,这反过来诱导E3泛素连接酶RNF114的表达。RNF114与丝状肌动蛋白结合,导致其下调和重排,从而抑制T细胞中的牵引力。在患有肿瘤的小鼠中,注射从动物身上收集的细胞毒性T细胞,并用PIEZO1拮抗剂处理,促进它们浸润到肿瘤中,并减弱肿瘤的生长。作为一种免疫力学调节剂,PIEZO1可以靶向提高癌症免疫治疗的效果。

免疫检查点阻断(ICB)为治疗各种癌症提供了有希望的治疗机会,包括转移性黑色素瘤、非小细胞肺癌和肾癌。然而,由于疗效有限,临床结果往往受到影响,导致患者频繁复发。为了在基于ICB的治疗中绕过这一瓶颈,需要进一步了解T细胞在免疫反应中的作用和调节,特别是在癌症生物学的背景下。
一个新兴的研究领域是关注对T细胞机械生物学的理解;也就是T细胞对生物力学环境的感知和反应。到目前为止,已经描述了多种T细胞的生物力学传感器。一般来说,T细胞识别机械信号并将其转导到下游生化反应中,导致T细胞活化或抑制,从而调节T细胞的细胞毒性。在免疫突触上,细胞毒性T细胞可以在靶细胞表面产生张力,以增强穿孔蛋白介导的孔形成,最终靶向细胞进行破坏。在遇到僵硬的癌细胞时,细胞毒性T细胞也可以增强牵引力,增强其细胞毒性。然而,关于T细胞机械生物学和激活后细胞毒性之间联系的新兴机制见解需要进一步探索。
PIEZO1属于真核细胞中对机械力(如触觉和本体感觉)有反应的离子通道家族。通过检测和转导机械线索,PIEZO1对动态环境进行细胞调节并在调节先天免疫系统中起重要作用。在巨噬细胞中,过度活跃的PIEZO1与功能获得性突变会损害吞噬活性和红细胞周转,导致离子过载。在小鼠模型中,有缺陷的PIEZO1保护髓样细胞免于癌变并延长脓毒症的存活时间。PIEZO1还通过转换肺部的周期性机械力来刺激小鼠细菌感染的炎症。在适应性免疫应答过程中,PIEZO1参与T细胞的活化并选择性地抑制调节性T细胞,但不参与CD4+(分化4阳性簇)T细胞的效应功能。然而,对于PIEZO1如何调节活化的细胞毒性T细胞对肿瘤细胞的作用,人们知之甚少。
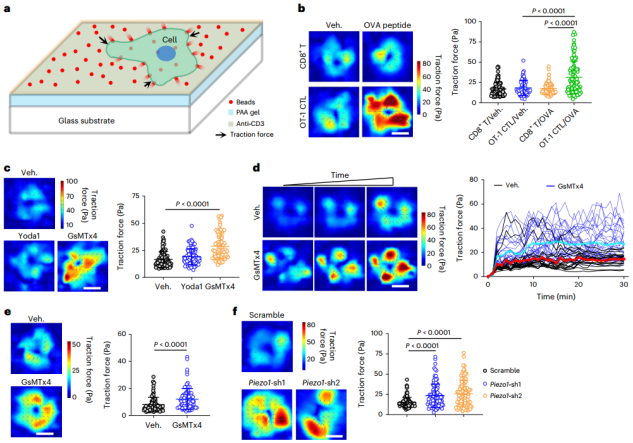
阻断PIEZO1可增强T细胞的牵引力(Credit: Nature Biomedical Engineering)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


