Nature:转录与翻译的协奏曲!揭示基因表达耦合的新调控模式
来源:生物探索 2024-12-13 09:44
研究人员首次在实验室中重建了完整的转录-翻译偶联系统,并利用多色单分子荧光显微镜技术,实时追踪了转录延伸、翻译延伸以及两者之间的耦合。
在生命科学中,基因表达是一个至关重要的过程,其中遗传信息从DNA转录为RNA,再通过翻译合成蛋白质。这一复杂而精确的机制驱动了所有生物的生命活动。然而,您是否想过,在细胞内部,这些看似分离的过程是如何紧密协作以实现高效基因表达的?特别是在细菌中,转录和翻译发生在同一细胞间隔中,这为两者之间的功能偶联(coupling)提供了可能性。
多年来,研究人员已经通过高分辨率技术观察到RNA聚合酶(RNA polymerase, RNAP)和核糖体(ribosome)之间的物理连接。然而,这些静态“快照”只能展示瞬间的结构,而无法揭示这些分子机器在动态过程中如何合作。为解开这一谜题,研究人员首次在实验室中重建了完整的转录-翻译偶联系统,并利用多色单分子荧光显微镜(multi-color single-molecule fluorescence microscopy)技术,实时追踪了转录延伸、翻译延伸以及两者之间的耦合。(12月4日 Nature “Tracking transcription–translation coupling in real time”)
研究结果令人惊叹:通过mRNA的环状折叠,核糖体和RNAP可以在数百个核苷酸的距离内实现长程物理耦合,而这种联系的关键调控因子是NusG蛋白。此外,核糖体不仅能通过碰撞解除RNAP的暂停,还能在没有直接碰撞的情况下通过耦合激活被NusA调控暂停的RNAP。这一发现颠覆了传统观点,为基因表达的高效调控提供了全新的视角。

基因表达的协作谜题:从转录到翻译的连接
生命活动的本质离不开基因表达,这一复杂过程将DNA中的遗传信息通过转录转化为RNA,再由翻译合成蛋白质。转录和翻译看似是独立的两个步骤,但它们在细菌中却发生于同一细胞间隔,这为两者间的物理和功能耦合(coupling)提供了可能性。这种耦合不仅在细胞内具有重要意义,还对基因表达的调控效率至关重要。
已有研究表明,转录和翻译之间的耦合可以防止RNA聚合酶(RNA polymerase, RNAP)在转录过程中暂停,甚至通过阻止Rho蛋白的终止作用来提升转录效率。然而,这种协作的具体机制仍然模糊。高分辨率结构研究曾揭示,RNAP和核糖体之间可能通过NusG等转录因子实现直接的物理连接,这一复合体被称为“表达体”(expressome)。尽管如此,这些研究大多基于静态结构“快照”,未能解释分子机器如何在动态过程中协调工作。
一个关键问题是,转录和翻译的速度如何被协调?传统观点认为,核糖体需紧随RNAP之后才能通过碰撞或直接物理作用激活暂停的RNAP。然而,这种观点无法解释核糖体与RNAP分离较远时是否仍可实现协作。此外,对于动态过程中RNAP和核糖体如何感知并响应彼此的状态,研究也存在空白。
为了填补这一知识空缺,研究人员通过多色单分子荧光显微镜技术,首次在实验室中重建了完整且活跃的转录-翻译偶联系统,直接观察到两者如何在实时动态中协调工作。
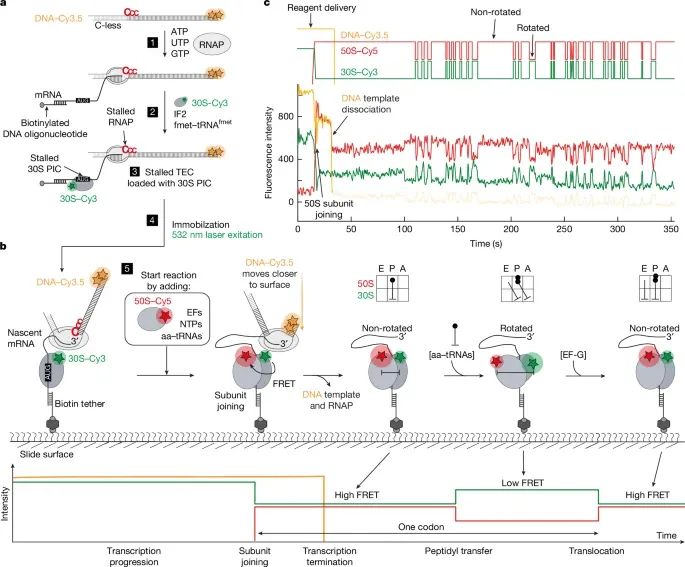
单分子实时追踪共转录翻译延伸的实验系统(Credit: Nature)
a. 实验设计: 转录-翻译复合体的制备方法,用于重建细菌中转录和翻译同时发生的场景。在这一系统中,研究人员使用了一种特殊设计的DNA模板,其中包含一个缺失胞苷(C-less)的序列和一个连续三个胞苷(CCC)的序列。这种设计旨在精确控制RNA聚合酶(RNAP)的转录起始和暂停。此外,通过将RNAP和mRNA锚定在功能化的玻璃表面上,研究人员成功构建了可以进行实时动态观察的复合体系。
b. 单分子实验系统: 研究利用多色荧光标记方法,同时追踪同一mRNA分子上转录和翻译的动态过程。具体来说,DNA模板上标记了Cy3.5荧光,30S核糖体亚基标记了Cy3,50S亚基则标记了Cy5。通过监测荧光共振能量转移(FRET)信号,研究人员可以捕捉到RNAP与核糖体之间的相互作用动态。右上角的示意图展示了翻译延伸过程中tRNA在核糖体A、P、E位点的构象变化,而底部图示则描绘了理想情况下荧光信号的变化模式。
c. 实验结果的代表性单分子轨迹: 图c展示了代表性的单分子轨迹,黄色曲线表示转录的荧光强度变化,红色和绿色曲线则反映了翻译的荧光信号变化。这些数据被平滑化处理以便更清晰地呈现动态趋势。实验轨迹显示,随着RNAP沿DNA模板的移动,mRNA逐步合成,与此同时,核糖体结合到新生的mRNA上并开始翻译。上方的理想化曲线总结了实验中观测到的转录和翻译同步进程的规律性。
动态系统的重建:实时“观看”分子机器的合作
观察动态过程的挑战在于分子行为的瞬时性和复杂性。为了解决转录和翻译如何协作的科学难题,研究人员开创性地利用多色单分子荧光显微镜技术(multi-color single-molecule fluorescence microscopy),实现了对分子机器动态协作过程的“实时追踪”。
这一技术的核心在于通过荧光标记分子实现精确定位和动态监测。研究团队首先在实验室中重建了一个完整且活跃的转录-翻译偶联系统,模拟了细菌细胞内的自然环境。他们设计了一种特殊的实验装置,将DNA模板、RNA聚合酶(RNAP)和核糖体精确组装到功能化玻璃表面,利用荧光标记追踪转录和翻译的延伸过程。RNAP通过合成mRNA驱动转录,核糖体则结合到生成的mRNA上,启动翻译。
实验中,研究人员使用多种荧光标记分子:DNA标记上Cy3.5,30S核糖体亚基标记上Cy3,50S亚基标记上Cy5。通过检测这些标记分子之间的荧光共振能量转移(Förster Resonance Energy Transfer, FRET),可以精确捕捉转录和翻译的同步进程以及两者的物理耦合状态。这一创新技术不仅可以观察转录或翻译的单一过程,还能首次实现对同一分子上两种过程的同步动态监测。
核糖体与RNA聚合酶的“长距离对话”
在细胞中,RNA聚合酶(RNAP)和核糖体这两台分子机器承担着基因表达的重任。传统观念认为,这两者只有在距离极近时才能通过直接碰撞实现耦合。然而,该研究表明,即使它们相隔数百个核苷酸,也可以通过mRNA的环状折叠实现“长距离对话”,这颠覆了人们对分子耦合的传统认识。
研究人员通过多色单分子荧光显微镜技术发现,当mRNA长度达到几十甚至几百个核苷酸时,其能够形成环状结构,将RNAP与核糖体物理连接起来。荧光共振能量转移(FRET)实验数据显示,在两者间的mRNA长度为46个核苷酸时,约65%的复合体处于耦合状态;而当长度增加到457个核苷酸时,这一比例下降到8%。尽管如此,即使在mRNA较长的情况下,RNAP和核糖体仍能通过这种物理耦合保持协作。
这一过程中,NusG蛋白起到了至关重要的作用。作为一种转录因子,NusG在RNAP和核糖体之间充当“桥梁”,促进它们的物理连接,同时稳定mRNA的环状结构。实验表明,在加入NusG后,RNAP与核糖体的耦合效率显著提高,即便是在较长的mRNA间隔下,这种效应依然显著。相比之下,没有NusG的系统中,耦合状态的复合体比例明显下降。
这一发现的重要性在于,它拓展了对基因表达调控机制的理解。通过这种长程物理耦合,核糖体能够与RNAP保持“对话”,协调两者的活动,提升基因表达效率。同时,这种机制还可能让RNAP对mRNA链上其他核糖体的加载情况有所“感知”,从而优化整个表达过程。
碰撞还是合作?核糖体如何激活暂停的RNAP
RNA聚合酶(RNAP)在基因表达过程中并非一直流畅工作,它会因DNA链上的障碍或自身的“犹豫”而暂停。核糖体如何在这样的时刻帮助RNAP重新启动,成为研究的一个关键问题。该研究揭示了核糖体激活RNAP的两种机制:物理碰撞和长程耦合,这为我们提供了更深入的理解。
研究人员通过单分子荧光显微镜技术观察到,当RNAP暂停时,紧随其后的核糖体可以通过直接物理碰撞推动RNAP,解除其暂停状态。然而,碰撞并非唯一方式。实验显示,即使核糖体和RNAP之间相距数十到上百个核苷酸,核糖体仍可通过mRNA环状折叠形成的长程物理耦合,激活暂停的RNAP。这一发现颠覆了此前认为只有“紧追”状态下才能发生协作的传统观点。
这一机制的核心调控因子是NusA蛋白。NusA通常被认为是RNAP的“刹车”,在转录过程中通过稳定发夹结构的方式延长RNAP暂停时间。然而,研究表明,当核糖体通过物理耦合与RNAP相连时,NusA的作用会发生变化。此时,NusA无法再维持其“刹车”功能,反而会促进RNAP的重新启动,成为一种“助推器”。实验数据显示,在仅有NusA存在的情况下,暂停的RNAP需要大约205秒才能重新开始转录;但当核糖体参与耦合后,这一时间缩短至约100秒,效率提升了一倍。
更有趣的是,这种长程耦合还可以突破距离限制。在实验中,研究人员发现即使在mRNA上有超过100个核苷酸的间隔,核糖体依然能够通过这种方式显著加速RNAP从暂停状态的恢复。
解码偶联效率:RNA长度与耦合动态的秘密
基因表达的精准调控离不开转录与翻译的高效协作。然而,RNA分子的长度在这一过程中扮演了怎样的角色?该研究揭示了mRNA长度对核糖体与RNA聚合酶(RNAP)耦合效率的深远影响,以及Nus因子在其中的精细调控机制。
实验发现,当mRNA长度较短(例如46个核苷酸)时,RNAP和核糖体的耦合状态十分稳定,约65%的复合体能保持紧密耦合。然而,随着mRNA长度增加到457个核苷酸,耦合效率显著下降,仅有8%的复合体处于耦合状态。这表明,随着两者间距拉大,长距离耦合的稳定性逐渐减弱。
这一变化的核心原因在于mRNA的物理特性和环状折叠能力。当mRNA较短时,其刚性更强,能够稳定地桥接RNAP和核糖体。而在较长的mRNA中,其柔性增加,分子结构趋于松散,难以维持稳定的耦合状态。
在这一过程中,NusG因子的作用尤为关键。研究显示,NusG通过稳定RNAP和核糖体之间的桥接,显著提升耦合效率,尤其是在较长mRNA间隔的情况下。与之相对,NusA因子则会使表达体(expressome)结构略微松散,削弱耦合效率。然而,当两者共同作用时,NusA和NusG可以协同工作,既保持耦合状态的稳定性,又调控RNAP的转录速度。
进一步的单分子实验发现,RNAP和核糖体在长mRNA上可以动态“配对”——即在耦合和解耦之间转换。尤其在较长mRNA(例如85个核苷酸以上)的情况下,这种动态耦合显得尤为重要,为RNAP的调控提供了更多灵活性。
从细菌到复杂生命体的广泛启示
基因表达是所有生命形式的基础,但细菌中转录与翻译的协作机制,为我们理解生命复杂性提供了独特的视角。该研究从分子层面揭示了细菌中RNA聚合酶(RNAP)与核糖体的耦合过程,展示了基因表达的动态调控模式,并为其他复杂细胞过程提供了深远的启示。
通过实验观察到的mRNA环状折叠和长程耦合机制,不仅打破了对基因表达局限于短距离协作的传统认识,还提出了全新的基因表达模式。即使在RNAP和核糖体之间相距数百个核苷酸的情况下,它们仍可以通过mRNA桥梁保持功能上的紧密联系。这种“远距离对话”机制可能并非细菌所独有,也可能在真核生物中起到重要作用,例如真核细胞中的转录-剪接偶联或翻译调控过程。
此外,研究强调了调控因子NusG和NusA在偶联动态中的作用。这些因子通过稳定或解耦RNAP和核糖体,为基因表达提供了灵活性。这种协作模式不仅提高了转录和翻译的效率,还可能是细菌快速响应环境变化的重要基础。类似的调控因子可能在复杂的真核生物中也起到类似作用,例如调控转录因子与核糖体之间的相互作用。
这一发现对细胞过程研究的推动意义深远。它启发我们重新审视生命过程中分子机器的协作方式。例如,在细胞骨架动态组装、信号传递或分子马达的运作中,是否也存在类似的远距离协作模式?答案可能为生命科学的多个领域提供新的研究方向。
更重要的是,这项研究为开发新的基因调控工具铺平了道路。通过精准操控RNAP和核糖体的耦合状态,我们或许可以开发出更高效的生物技术方法,用于合成生物学或基因治疗。这不仅揭示了生命本身的奥秘,也为解决我们面临的实际问题提供了希望。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


