研究揭示新冠病毒核衣壳蛋白通过相变促进宿主炎症反应的新机制
来源:中山大学 2021-05-04 21:33
新冠病毒(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)引发的新冠肺炎(coronavirus disease 2019, COVID-19)疫情目前仍在全球肆虐。研究表明,病毒引起的异常炎症反应与COVID-19疾病进展密切相关。在病毒感染过程中,病毒会诱导机体免疫系统产生趋化因子及
新冠病毒(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)引发的新冠肺炎(coronavirus disease 2019, COVID-19)疫情目前仍在全球肆虐。研究表明,病毒引起的异常炎症反应与COVID-19疾病进展密切相关。在病毒感染过程中,病毒会诱导机体免疫系统产生趋化因子及炎症因子,招募免疫细胞清除病毒。然而,在部分患者中,病毒介导的免疫反应会过度激活,导致严重的炎症反应,并产生“炎症因子风暴”,造成组织损伤,多器官衰竭,甚至患者死亡。因此,探究新冠病毒引起过度炎症的途径及机制,并以此为基础减轻新冠病毒引起的炎症反应,有望改善患者临床预后。然而,新冠病毒感染过程中激活宿主炎症反应的具体分子机制目前尚不明确。
核衣壳(N)蛋白是冠状病毒中含量和保守性最高的蛋白,是病毒粒子的核心成分。N蛋白不仅能识别病毒RNA并将其包装成核糖核蛋白(RNP)复合体,还能通过与病毒或宿主蛋白结合,参与病毒转录、复制、免疫调节等多个进程。近数月内,国内外多个研究组发现新冠病毒N蛋白能与病毒RNA形成“液-液相分离”这一现象1-4。“液-液”相分离(LLPS)是在生命科学领域迅速发展起来的新概念。在一定条件下,溶液中的生物大分子会因相互作用而高度聚集浓缩,从普通溶液相中分离出来,形成独立而粘稠的液体相(LLPS液滴)。生物大分子相分离被认为是介导细胞内无膜细胞器及无膜颗粒形成的重要机制。LLPS相继被发现参与基因调控、信号转导、应激反应等多个关键细胞进程,并迅速成为生命科学领域的研究前沿。那么新冠病毒N蛋白形成的LLPS是否参与病毒介导的炎症反应进程呢?
中山大学生命科学学院崔隽教授团队和广州医科大学呼吸疾病国家重点实验室赵金存教授团队合作,该研究在新冠病毒N蛋白与病毒RNA结合形成LLPS的基础上,进一步探究了新冠病毒N蛋白LLPS与宿主炎症反应的关联情况,揭示了新冠病毒利用N蛋白LLPS促进宿主NF-κB通路的过度活化及炎症反应的分子机制。
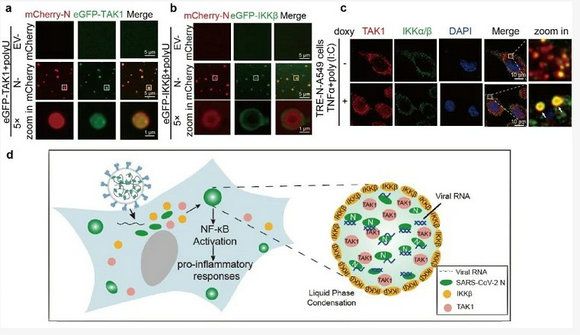
此前,崔隽教授团队及国内外不同团队的研究成果表明,新冠病毒中多个蛋白参与抑制宿主固有免疫反应5-8。本研究发现,与过去具有负向调控宿主免疫的病毒蛋白不同,新冠病毒的N蛋白能在病毒感染后期促进宿主的炎症反应,这可能与新冠病毒引起的细胞因子风暴相关。进一步机制研究表明,新冠病毒N蛋白能招募NF-κB通路中的关键激酶TAK1及IKKβ,促进TAK1与IKKβ的相互作用,并激活IKKβ磷酸化。通过促进TAK1与IKKβ相互结合,N蛋白促进宿主NF-κB通路的激活,诱导细胞分泌大量促炎性细胞因子,包括IL-6、IL-1β、IL-8和TNFα等。
进一步研究表明,新冠病毒的N蛋白能结合病毒单链及双链的RNA并形成“液-液相分离聚集体”。细胞内及体外重构实验表明,病毒RNA-N蛋白相分离聚集体能招募TAK1及IKKβ,并把TAK1与IKKβ带入RNA-N蛋白聚集体中。而RNA-N蛋白的相分离具有一定选择性,RNA-N蛋白能把TAK1带入相分离聚集体内,形成激活核心,同时把IKKβ结合在相分离液滴的外围,形成特殊的外环结构,这种结构可能增大IKKβ与下游分子的结合面积,并增强IKKβ的激酶活性(如图)。此外,使用1,6己二醇(LLPS抑制剂)处理抑制N蛋白相分离形成,不仅减弱病毒感染过程中TAK1与IKKβ的相互作用,而且能抑制新冠病毒感染抑制的炎症反应及炎症因子释放。
综上所述,该研究发现了新冠病毒及编码的N蛋白对宿主NF-κB通路及炎症反应的促进作用,揭示了N蛋白通过LLPS招募NF-κB关键激酶TAK1及IKKβ并形成相分离复合体的分子机制,并为新冠肺炎治疗提出靶向相分离的新型抑炎策略。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


