上海交通大学的研究者们揭示了胃癌的一个有希望的治疗靶点
来源:生物谷原创 2023-12-05 14:51
在全球范围内,胃癌(GC)的诊断患病率在癌症中排名第五,主要死亡原因排名第三。探索基因组调控网络中影响细胞存活的重要基因对于将分子表征转化为有用的临床应用至关重要。
在全球范围内,胃癌(GC)的诊断患病率在癌症中排名第五,主要死亡原因排名第三。探索基因组调控网络中影响细胞存活的重要基因对于将分子表征转化为有用的临床应用至关重要。由于肿瘤组织细胞及其与微环境的复杂关系影响肿瘤发生发展的方方面面,基因在调节微环境表型和功能中的作用值得深入研究。

图片来源:https://doi.org/10.1186/s13046-023-02861-4
近日,来自上海交通大学的研究者们在J Exp Clin Cancer Res.杂志上发表了题为“Paracrine activin B-NF-κB signaling shapes an inflammatory tumor microenvironment in gastric cancer via fibroblast reprogramming” 的文章,该研究表明GC细胞p65/INHBB/激活素B和成纤维细胞p65/IL-1β信号环导致整个促肿瘤炎症微环境的形成,这可能是GC的一个有希望的治疗靶点。
INHBB在各种恶性肿瘤中的重要作用越来越被确认。胃癌(GC)微环境的潜在机制仍未被充分探索。
研究者通过分析公开数据库和人石蜡包埋GC组织,评估INHBB的临床意义以及INHBB与GC中p-p65的相关性。在体外和体内研究了GC细胞与成纤维细胞间INHBB的生物学串扰。RNA-seq分析确定了调节成纤维细胞重编程的机制。采用荧光素酶报告基因法和染色质免疫沉淀(CHIP)法验证GC细胞中p65与INHBB的结合关系。
研究表明,在GC患者中,INHBB水平明显升高,且INHBB升高与生存差相关。INHBB在体外对胃癌细胞的增殖、迁移和侵袭有正向调节作用。此外,激活素B通过将成纤维细胞重编程为癌症相关成纤维细胞(CAFs)来促进GC的发生。GC细胞中INHBB的高表达通过分泌激活素B激活正常胃成纤维细胞的NF-κB通路,促进成纤维细胞增殖、迁移和侵袭。
此外,激活素B通过控制TRAF6自身泛素化激活NF-κB通路,诱导成纤维细胞TAK1磷酸化。激活素B激活的成纤维细胞可通过释放促炎因子IL-1β诱导GC细胞p65磷酸化活化。p65可以直接结合INHBB启动子,增加GC细胞的INHBB转录,从而建立一个正调节反馈回路,促进GC的进展。
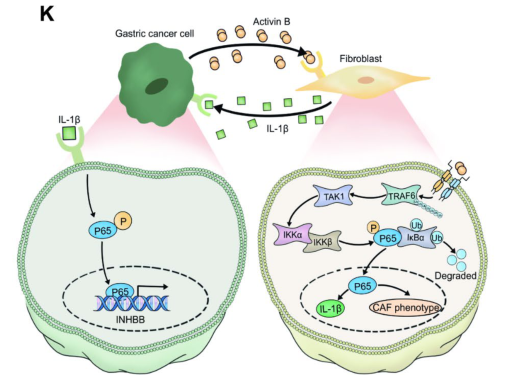
GC细胞和成纤维细胞之间的INHBB/NF-kB/IL-1b正调节反馈回路的图示,可以促进GC的进展
图片来源:https://doi.org/10.1186/s13046-023-02861-4
综上所述,INHBB在GC细胞和成纤维细胞之间形成了局部促肿瘤的炎症环境,为INHBB在GC发生发展中的作用提供了新的证据。这些发现具有现实意义,可以加深人们对INHBB在GC进展和治疗中的作用的认识。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


